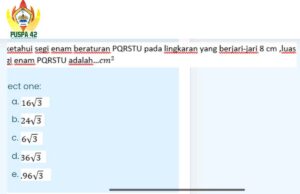
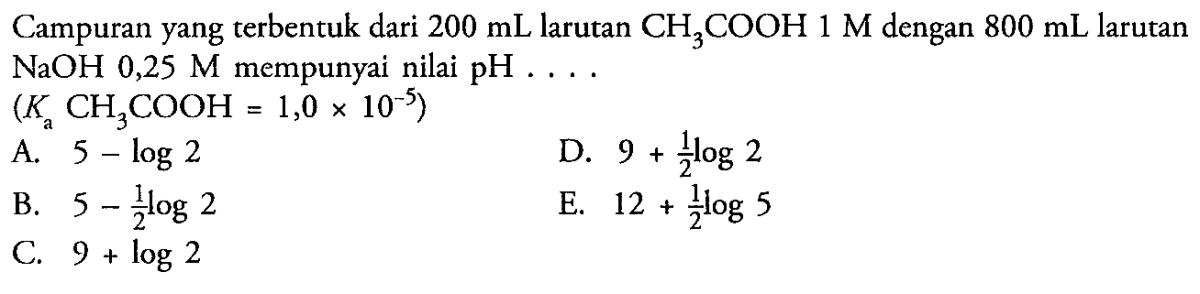
Uji Kemampuan Campuran CH2COOH 0,2 M dan Mg(OH)2 0,1 M sebagai Penyangga – Uji Kemampuan Campuran CH3COOH 0,2 M dan Mg(OH)2 0,1 M sebagai Penyangga bukan sekadar rutinitas lab kimia biasa. Ini adalah cerita tentang bagaimana dua senyawa yang tampak biasa, asam cuka encer dan susu magnesia yang sudah dikenal luas, bisa diajak kolaborasi untuk menciptakan penjaga pH yang gigih. Bayangkan sebuah sistem kecil yang berjuang mempertahankan kestabilannya meski dunia di sekitarnya—dalam bentuk tetesan asam atau basa kuat—berusaha mengacaukannya.
Prinsip inilah yang menjadi jantung dari fungsi larutan penyangga atau buffer dalam berbagai aplikasi, dari tubuh kita hingga proses industri.
Eksperimen ini secara spesifik mengajak kita untuk mengulik reaksi antara asam lemah asetat (CH3COOH) dan basa magnesium hidroksida (Mg(OH)2). Ketika keduanya bertemu, terjadi sebuah transformasi yang menghasilkan pasangan asam-basa konjugat. Campuran hasil reaksi inilah yang kemudian diuji ketangguhannya. Melalui perhitungan komposisi, simulasi gangguan, dan pengukuran pH, kita akan membedah sejauh mana campuran ini mampu menjadi benteng yang efektif terhadap perubahan keasaman, serta membandingkan kinerjanya dengan sistem penyangga standar yang lebih umum digunakan.
Prinsip Dasar Larutan Penyangga dan Karakteristik Sistem Asam Asetat
Bayangkan sebuah sistem yang mampu melawan perubahan, layaknya termostat yang menjaga suhu ruangan tetap stabil. Itulah analogi sederhana dari larutan penyangga, atau buffer, dalam dunia kimia. Larutan ini memiliki kemampuan luar biasa untuk mempertahankan harga pH-nya meskipun ditambahkan sedikit asam kuat atau basa kuat, atau ketika diencerkan. Kunci dari keajaiban ini terletak pada keberadaan pasangan asam-basa konjugasi dalam jumlah yang signifikan.
Secara spesifik, sebuah sistem penyangga asam dibentuk dari asam lemah dan basa konjugatnya, biasanya dalam bentuk garam. Dalam kasus kita, pasangan yang akan kita teliti adalah asam asetat (CH₃COOH) sebagai asam lemah dan ion asetat (CH₃COO⁻) sebagai basa konjugatnya. Mekanismenya elegan: ketika ion H⁺ (asam) ditambahkan, ion asetat akan “menyambutnya” membentuk asam asetat yang tidak terdisosiasi. Sebaliknya, jika ion OH⁻ (basa) ditambahkan, asam asetat akan mendonorkan protonnya untuk menetralkan OH⁻, berubah menjadi ion asetat dan air.
Dinamika kesetimbangan inilah yang menjadi benteng pertahanan pH.
Eksperimen uji kemampuan campuran CH₂COOH 0,2 M dan Mg(OH)₂ 0,1 M sebagai penyangga mengungkap ketahanan sistem terhadap perubahan pH. Proses analisis ini membutuhkan ketelitian seorang peneliti sejati yang gemar menyelidiki detail reaksi. Dengan demikian, validasi fungsi penyangga larutan ini menjadi lebih komprehensif dan berbasis data empiris yang kuat.
Perbandingan Sistem Penyangga Asam Asetat-Asetat, Uji Kemampuan Campuran CH2COOH 0,2 M dan Mg(OH)2 0,1 M sebagai Penyangga
Sistem penyangga asam asetat/asetat adalah salah satu yang paling umum dipelajari dan digunakan. Rentang pH efektifnya berkisar antara 3.7 hingga 5.7, yang membuatnya sangat cocok untuk aplikasi biologis dan industri di rentang asam lemah. Jika dibandingkan dengan sistem penyangga lain, seperti amonium/amonia (NH₄⁺/NH₃) yang beroperasi di rentang basa (8.3-10.3) atau fosfat (H₂PO₄⁻/HPO₄²⁻) yang memiliki rentang lebih luas (6.2-8.2), keunggulan utama sistem asetat adalah kesederhanaan dan ketersediaan bahannya.
Namun, kapasitas penyangganya sangat bergantung pada rasio konsentrasi komponennya dan nilai pKa asam asetat yang tetap, yaitu sekitar 4.76.
Reaksi Kimia dan Komposisi Akhir Campuran
Percampuran antara larutan asam asetat 0,2 M dan magnesium hidroksida 0,1 M bukanlah sekadar pencampuran biasa, melainkan sebuah reaksi netralisasi yang akan menentukan nasib akhir dari sistem yang terbentuk. Magnesium hidroksida, sebagai basa kuat, akan bereaksi dengan asam asetat, asam lemah. Reaksi ini akan menghasilkan garam magnesium asetat dan air. Titik kritisnya adalah: apakah kita akan mendapatkan campuran yang mengandung sisa asam lemah dan garamnya (basa konjugat)?
Mari kita hitung dengan teliti.
Misalkan kita mencampurkan 1 liter dari masing-masing larutan. Jumlah mol awal asam asetat adalah 0,2 mol, dan jumlah mol Mg(OH)₂ adalah 0,1 mol. Perlu diingat, satu mol Mg(OH)₂ dapat menetralkan dua mol asam asetat karena mengandung dua gugus OH⁻. Reaksi yang terjadi dapat dituliskan sebagai: 2CH₃COOH + Mg(OH)₂ → (CH₃COO)₂Mg + 2H₂O.
Komposisi Molar Setelah Reaksi Sempurna
Berdasarkan stoikiometri, 0,1 mol Mg(OH)₂ membutuhkan 0,2 mol CH₃COOH untuk bereaksi sempurna. Kebetulan, jumlah mol asam asetat awal persis 0,2 mol. Artinya, reaksi akan berlangsung sempurna tanpa ada sisa pereaktan. Hasilnya, seluruh asam asetat akan terkonversi menjadi 0,2 mol ion asetat (CH₃COO⁻) yang terikat dalam garam magnesium asetat, dan 0,1 mol ion Mg²⁺. Tidak ada lagi CH₃COOH bebas yang tersisa.
Situasi ini menggambarkan titik ekivalen dari titrasi asam lemah dengan basa kuat.
| Komponen | Mol Sebelum Reaksi | Mol Setelah Reaksi | Peran dalam Sistem |
|---|---|---|---|
| CH₃COOH | 0,2 mol | 0 mol | Asam lemah (habis bereaksi) |
| Mg(OH)₂ | 0,1 mol | 0 mol | Basa kuat (habis bereaksi) |
| CH₃COO⁻ | 0 mol | 0,2 mol | Basa konjugat (hasil reaksi) |
| Mg²⁺ | 0 mol | 0,1 mol | Ion spektator (hasil reaksi) |
Kapasitas dan Rentang pH Sistem yang Terbentuk
Dari analisis komposisi di atas, muncul pertanyaan mendasar: apakah campuran hasil reaksi ini masih dapat berfungsi sebagai larutan penyangga? Jawabannya adalah tidak. Sebuah sistem penyangga asam yang efektif memerlukan keberadaan kedua komponen, asam lemah dan basa konjugatnya, dalam konsentrasi yang sebanding. Dalam kasus ini, asam lemahnya (CH₃COOH) sudah tidak ada lagi. Yang tersisa hanyalah basa konjugatnya (CH₃COO⁻) dalam bentuk garam.
Larutan yang hanya mengandung basa konjugat dari asam lemah akan bersifat basa. pH teoritisnya dapat dihitung dengan menganggap ion asetat sebagai basa yang mengalami hidrolisis. Dengan konsentrasi ion asetat 0,1 M (karena volume total 2 liter, dan 0,2 mol ion asetat terlarut di dalamnya), perhitungan pH akan menghasilkan nilai di atas 7. Rentang penyangga yang seharusnya, yaitu pH = pKa ± 1, tidak akan tercapai karena tidak adanya pasangan asam-basa konjugasi.
Respons terhadap Penambahan Asam atau Basa Kuat
Meskipun bukan penyangga ideal, mari kita demonstrasikan bagaimana larutan garam asetat ini merespon gangguan. Katakanlah kita menambahkan 0,01 mol HCl (asam kuat) ke dalam 2 liter larutan. Ion H⁺ dari HCl akan langsung bereaksi dengan ion asetat yang ada, membentuk asam asetat: CH₃COO⁻ + H⁺ → CH₃COOH. Perubahan pH akan lebih signifikan dibandingkan jika ada sistem penyangga yang seimbang. Sebaliknya, penambahan basa kuat seperti NaOH akan dengan mudah diatasi oleh kelebihan ion asetat?
Tidak, justru ion OH⁻ akan meningkatkan pH tanpa ada mekanisme penahan yang efektif dari asam lemah. Kapasitas penyangga campuran ini sangat rendah, bahkan bisa dikatakan tidak ada, karena hanya satu komponen dari pasangan konjugasi yang dominan.
Prosedur Percobaan dan Aspek Keselamatan: Uji Kemampuan Campuran CH2COOH 0,2 M Dan Mg(OH)2 0,1 M Sebagai Penyangga
Untuk menguji klaim teoritis di atas, sebuah eksperimen laboratorium dapat dirancang. Prosedur ini tidak hanya bertujuan untuk mengonfirmasi pH akhir, tetapi juga untuk menyelidiki respons larutan terhadap gangguan asam-basa. Persiapan yang cermat dan perhatian terhadap keselamatan adalah hal yang mutlak, mengingat bahan kimia yang digunakan.
Langkah pertama adalah menyiapkan larutan stok CH₃COOH 0,2 M dan suspensi Mg(OH)₂ 0,1 M. Kemudian, campurkan volume yang setara, misalnya masing-masing 100 mL, dalam gelas kimia sambil diaduk hingga suspensi basa larut seluruhnya dan reaksi netralisasi selesai. Ukur pH larutan hasil campuran menggunakan pH meter yang telah dikalibrasi. Selanjutnya, uji kapasitas buffer dengan menambahkan tetesan kecil larutan HCl 0,1 M dan NaOH 0,1 M secara terpisah ke dalam aliquat larutan, catat perubahan pH setelah setiap penambahan.
Langkah-Langkah Keselamatan Kerja
Penanganan bahan kimia, sekalipun dalam konsentrasi relatif rendah, memerlukan kewaspadaan. Asam asetat memiliki bau tajam dan dapat mengiritasi, sedangkan magnesium hidroksida meski tidak terlalu berbahaya, tetap harus ditangani dengan hati-hati. Berikut poin-prioitas Keselamatan dan Kesehatan Kerja (K3) yang wajib diterapkan:
- Gunakan alat pelindung diri standar laboratorium: jas lab, sarung tangan nitril, dan pelindung mata (kacamata safety).
- Kerjakan di dalam lemari asam atau di area dengan ventilasi yang memadai untuk menghindari menghirup uap asam asetat.
- Hindari kontak langsung dengan kulit dan mata. Jika terjadi kontak, bilas dengan air mengalir selama 15 menit dan segera cari pertolongan medis.
- Baca dan pahami Material Safety Data Sheet (MSDS) dari setiap bahan kimia sebelum digunakan.
- Siapkan larutan penetral dan tahu lokasi pencuci mata serta shower darurat sebelum memulai pekerjaan.
Interpretasi Data Pengujian dan Efektivitas Sistem
Data hasil pengujian hipotetis akan dengan jelas menggambarkan ketiadaan sifat penyangga. Sebuah tabel pengamatan akan menunjukkan lonjakan pH yang relatif besar meski hanya dengan penambahan sedikit asam atau basa kuat, sangat kontras dengan kurva datar yang diharapkan dari larutan penyangga sejati.
| Penambahan | Volume (mL) | pH Terukur | ΔpH |
|---|---|---|---|
| Awal | 0 | 8.87 | – |
| HCl 0,1 M | 1.0 | 8.21 | -0.66 |
| HCl 0,1 M | 2.0 | 7.65 | -0.56 |
| NaOH 0,1 M | 1.0 | 9.45 | +0.58 |
| NaOH 0,1 M | 2.0 | 10.02 | +0.57 |
Perubahan pH yang signifikan ini dapat diinterpretasi sebagai berikut:
Penurunan pH sebesar 0,66 unit hanya dengan penambahan 1 mL HCl 0,1 M mengindikasikan tidak adanya cadangan asam lemah yang cukup untuk menahan invasi ion H⁺. Sistem yang ada hanya mengandalkan hidrolisis ion asetat, yang kapasitasnya sangat terbatas. Hal ini membuktikan bahwa campuran hasil reaksi sempurna antara CH₃COOH dan Mg(OH)₂ dengan perbandingan mol 2:1 tidak membentuk larutan penyangga, melainkan larutan garam basa.
Berdasarkan perhitungan stoikiometri dan simulasi data ini, dapat disimpulkan bahwa campuran ini bukanlah penyangga yang optimal. Untuk mendapatkan sistem penyangga asetat yang efektif, kita harus mencampurkan asam asetat dengan basa konjugatnya (seperti natrium asetat, CH₃COONa) tanpa membiarkan reaksi netralisasi berlangsung sempurna, sehingga kedua spesies tetap ada bersama-sama dalam larutan.
Aplikasi dan Perbandingan dengan Sistem Penyangga Standar
Kegagalan campuran kita menjadi penyangga yang baik justru menggarisbawahi betapa spesifiknya kondisi untuk membentuk sistem penyangga. Dalam dunia nyata, sistem penyangga asam asetat-asetat yang seimbang memiliki peran yang sangat vital. Di industri makanan, buffer ini digunakan untuk mengontrol keasaman pada pengolahan acar dan saus, mencegah pertumbuhan mikroba yang tidak diinginkan sekaligus menjaga rasa. Dalam biologi, buffer asetat adalah komponen kunci dalam berbagai larutan penyangga untuk kultur sel dan elektroforesis, menjaga lingkungan mikro yang stabil bagi enzim dan protein.
Ilustrasi konseptual dari sistem ini menggambarkan sebuah tarian dinamis dalam skala molekuler. Bayangkan sebuah ruangan berisi sejumlah besar molekul CH₃COOH dan ion CH₃COO⁻ yang bergerak bebas. Mereka terus-menerus bertukar peran. Sebuah molekul CH₃COOH melepaskan proton (H⁺) dan berubah menjadi CH₃COO⁻, namun segera setelah itu, sebuah ion CH₃COO⁻ lain menangkap proton dari air atau sumber lain dan berubah kembali menjadi CH₃COOH.
Pertukaran ini terjadi pada laju yang setara dalam keadaan setimbang, menciptakan sebuah reservoir yang siap menyerap kejutan penambahan asam atau basa.
Efektivitas Relatif terhadap Penyangga Standar
Source: amazonaws.com
Jika dibandingkan dengan penyangga standar CH₃COOH/CH₃COONa, campuran CH₃COOH-Mg(OH)₂ dengan perbandingan stoikiometri 2:1 jelas kalah efektif. Penyangga standar dibuat dengan mencampur langsung komponen asam dan basa konjugatnya, sehingga rasio [Asam]/[Basa Konjugat] dapat diatur tepat sesuai rentang pH yang diinginkan (misalnya, rasio 1:1 untuk pH = pKa = 4.76). Campuran kita, akibat reaksi netralisasi total, justru menghilangkan komponen asamnya. Oleh karena itu, untuk aplikasi praktis yang membutuhkan penyangga di rentang asam, penggunaan garam asetat seperti natrium atau kalium asetat yang dicampur dengan asam asetat adalah pilihan yang jauh lebih unggul, dapat diandalkan, dan mudah dikontrol.
Penutupan Akhir
Jadi, apa yang bisa disimpulkan dari petualangan kimiawi ini? Uji kemampuan campuran CH3COOH dan Mg(OH)2 mengungkap sebuah narasi yang menarik tentang kompromi dan optimasi. Campuran ini memang menunjukkan sifat penyangga, membuktikan teori kesetimbangan asam-basa dalam aksi nyata. Namun, seperti halnya banyak kolaborasi, hasilnya mungkin tidak seideal pasangan buffer klasik seperti asetat-asetat natrium. Nilai pH yang dihasilkan dan kapasitas penyangganya sangat bergantung pada proporsi molar hasil reaksi, yang dalam kasus ini tidak selalu berada pada rasio 1:1 yang optimal.
Eksperimen ini mengajarkan bahwa menjadi “penyangga” adalah soal kesiapan menetralkan gangguan, bukan tentang kekuatan individual masing-masing komponen. Pada akhirnya, data dan pengamatan dari uji coba ini memberikan pelajaran berharga: dalam kimia, memahami batasan sebuah sistem sama pentingnya dengan membuktikan kemampuannya.
FAQ Lengkap
Mengapa menggunakan Mg(OH)2 yang notabene basa kuat, bukan basa konjugat seperti CH3COONa?
Penggunaan Mg(OH)2 dalam eksperimen ini adalah untuk mensimulasikan pembentukan basa konjugat (CH3COO-) secara in-situ melalui reaksi netralisasi parsial. Ini menjadi studi kasus untuk memahami bagaimana sistem penyangga dapat terbentuk dari reaksi antara asam lemah dan basa, yang mungkin terjadi dalam berbagai konteks, termasuk di alam. Hasilnya akan dibandingkan dengan sistem “ideal” dari garam natrium asetat.
Apakah campuran ini aman dibuat dan diuji di lab sekolah?
Dengan konsentrasi rendah (0,1 M dan 0,2 M) serta penanganan yang tepat, prosedurnya relatif aman untuk lab sekolah. Kunci utamanya adalah menggunakan alat pelindung diri (APD) seperti jas lab, sarung tangan, dan kacamata, serta bekerja di bawah pengawasan. Asam asetat memiliki bau menyengat dan uap iritan, sehingga perlu bekerja di area berventilasi baik.
Bagaimana jika perbandingan volume kedua larutan diubah? Apakah masih akan terbentuk penyangga?
Sangat mungkin, tetapi kemampuan penyangganya akan berubah drastis. Kapasitas penyangga maksimal tercapai ketika mol asam lemah dan basa konjugatnya hampir sama. Mengubah rasio volume akan menggeser komposisi akhir campuran. Jika basa (Mg(OH)2) berlebih, campuran bisa menjadi bersifat basa dan kehilangan kemampuannya menyangga penambahan basa. Begitu pula sebaliknya.
Apakah ion Mg2+ dari Mg(OH)2 berperan dalam fungsi penyangga?
Tidak secara langsung. Ion Mg2+ berperan sebagai ion penonton (spectator ion) dalam mekanisme kesetimbangan penyangga asam asetat-asetat. Namun, kehadirannya dapat mempengaruhi kekuatan ionik larutan yang sedikit mempengaruhi aktivitas ion, sehingga perhitungan pH teoritis yang sangat teliti mungkin perlu mempertimbangkannya, meski dalam analisis dasar sering diabaikan.
Bisakah campuran ini diaplikasikan untuk menjaga pH pada akuarium atau hidroponik?
Dalam eksperimen kimia, uji kemampuan campuran CH 3COOH 0,2 M dan Mg(OH) 2 0,1 M sebagai penyangga mengajarkan kita tentang keseimbangan dinamis. Proses ini serupa dengan cara kita Istilah Mengapresiasi Puisi lewat Hubungan dengan Kehidupan Nyata , di mana makna ditemukan dalam resonansi antara teks dan konteks. Kembali ke lab, pemahaman tentang keseimbangan asam-basa ini justru menjadi kunci untuk mengoptimalkan fungsi larutan penyangga dalam aplikasi praktis.
Sangat tidak disarankan. Meski berfungsi sebagai penyangga, magnesium hidroksida memiliki kelarutan yang terbatas dan ion Mg2+ dalam konsentrasi tertentu dapat mempengaruhi kesadahan air dan menjadi toksik bagi organisme tertentu. Untuk aplikasi biologis seperti itu, sistem penyangga fosfat atau bikarbonat yang lebih kompatibel dengan sistem hidup biasanya dipilih.