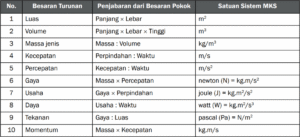
Hitung fungsi CO dan massa magnetit untuk menghasilkan 5 kg besi (efisiensi 88 %) bukan sekadar angka di kertas, tapi cerita tentang bagaimana si reduktor ulung, karbon monoksida, beraksi menaklukkan bijih magnetit di dalam perut tanur tinggi. Bayangkan proses menakjubkan ini, di mana Fe₃O₄ yang keras kepala akhirnya melepaskan oksigennya dan berubah menjadi logam besi yang kuat, fondasi peradaban modern kita. Namun, di dunia nyata, tidak ada proses yang sempurna; selalu ada energi yang terbuang, material yang lolos, atau reaksi samping yang mengganggu, sehingga efisiensi 88% menjadi angka realistis yang memisahkan teori ideal di laboratorium dengan praktik berdebu di industri.
Mari kita telusuri lebih dalam dengan pendekatan stoikiometri, ilmu yang mempelajari hubungan kuantitatif pereaksi dan hasil reaksi. Analisis ini akan mengungkap secara tepat berapa kilogram magnetit yang harus kita tambang dan berapa volume gas CO yang harus disiapkan untuk misi menghasilkan 5 kilogram besi murni. Perhitungannya seperti resep rahasia, di mana setiap gram bahan baku diperhitungkan, namun dengan catatan penting: resep teoritis harus dikoreksi dengan faktor efisiensi agar hasilnya sesuai kenyataan di lapangan.
Dari Batu Magnet ke Besi Murni: Peran Kunci CO dan Magnetit
Bayangkan sebuah batu hitam yang bisa menarik logam, seperti magnet. Itulah magnetit, salah satu harta karun alam yang menjadi sumber besi kita. Tapi, untuk mengubah batu magnetik itu menjadi besi yang bisa digunakan untuk membuat rangka gedung atau badan mobil, kita butuh seorang pahlawan tak kasat mata: Karbon Monoksida (CO). Gas ini bertindak sebagai reduktor, sebuah zat yang “merampas” oksigen dari bijih besi, menyisakan logam besi murni.
Proses ini adalah jantung dari industri besi dan baja, namun jalan dari teori ke praktiknya tidak pernah sempurna. Efisiensi 88% yang disebutkan itu adalah pengakuan jujur bahwa di dunia nyata, ada banyak faktor yang membuat hasil tak pernah mencapai 100%, seperti kehilangan panas, reaksi samping, atau ketidaksempurnaan kontak antara gas dan bijih.
Peran CO dan Sifat Magnetit dalam Reduksi Besi
Karbon monoksida (CO) adalah reduktor gas yang ideal dalam tanur tinggi. Ia bekerja dengan cara bereaksi dengan oksigen yang terikat pada bijih besi, mengubahnya menjadi karbon dioksida (CO₂) dan meninggalkan besi dalam bentuk unsur. Sementara itu, magnetit, dengan rumus kimia Fe₃O₄, adalah bijih besi yang sangat istimewa. Ia sebenarnya adalah campuran dari FeO dan Fe₂O₃, memiliki sifat magnetik yang kuat, dan kandungan besinya yang tinggi (sekitar 72.4% secara teoritis) membuatnya sangat ekonomis untuk ditambang dan diolah.
Perbandingan antara efisiensi teoritis dan nyata terletak pada detail operasional. Secara teori, setiap molekul CO akan bereaksi sempurna. Namun di industri, faktor seperti ukuran bijih yang tidak seragam, aliran gas yang tidak merata, dan kebocoran panas membuat sebagian energi dan bahan baku terbuang, sehingga kita perlu berhitung dengan angka efisiensi di bawah 100%.
Mengurai Angka: Stoikiometri Reduksi Magnetit Menjadi Besi: Hitung Fungsi CO Dan Massa Magnetit Untuk Menghasilkan 5 kg Besi (efisiensi 88 %)
Stoikiometri adalah resep raksasa untuk reaksi kimia. Ia memberi tahu kita proporsi pasti bahan baku yang dibutuhkan untuk menghasilkan produk tertentu. Untuk mengubah magnetit menjadi besi, kita perlu resep yang tepat. Mari kita tuliskan persamaan reaksi setaranya, yang menjadi fondasi semua perhitungan kita selanjutnya. Dari sana, kita bisa menghitung berapa kilogram magnetit yang harus kita sediakan untuk mendapatkan 5 kg besi murni, dan kemudian menyesuaikannya dengan realita efisiensi pabrik sebesar 88%.
Persamaan Reaksi dan Perhitungan Massa Magnetit Teoritis
Reaksi reduksi lengkap magnetit oleh karbon monoksida dapat ditulis sebagai berikut:
Fe₃O₄ + 4 CO → 3 Fe + 4 CO₂
Dari persamaan ini, terlihat bahwa 1 mol Fe₃O₄ akan menghasilkan 3 mol Fe. Massa molar Fe₃O₄ adalah (3*55.85 + 4*16) = 231.55 g/mol, sedangkan massa molar Fe adalah 55.85 g/mol. Untuk menghasilkan 3 mol Fe (3
– 55.85 g = 167.55 g), dibutuhkan 231.55 g Fe₃O₄. Jadi, untuk menghasilkan 5 kg (5000 g) besi, perhitungan massanya adalah: (5000 g Fe)
– (231.55 g Fe₃O₄ / 167.55 g Fe) = 6910 gram atau sekitar 6.91 kg magnetit murni secara teoritis.
Namun, karena prosesnya hanya 88% efisien, bukan semua besi dalam bijih berhasil dikonversi. Kita perlu memasukkan lebih banyak bijih untuk mengkompensasi hal ini. Massa magnetit yang disesuaikan adalah: Massa teoritis / Efisiensi = 6.91 kg / 0.88 ≈ 7.85 kg.
Perhitungan stoikiometri untuk menghasilkan 5 kg besi dengan efisiensi 88% memang seru, mirip seperti menganalisis dinamika gerak melingkar. Nah, berbicara tentang analisis gerak, kamu bisa pelajari konsep seru tentang Menentukan Panjang Lintasan Lingkaran Berdasarkan Kecepatan dan Waktu Randi serta Rangga yang juga butuh ketelitian. Kembali ke topik kita, dari data efisiensi itu, kita bisa hitung berapa massa magnetit (Fe₃O₄) dan fungsi CO yang dibutuhkan secara presisi.
Menghitung Kebutuhan Gas Reduktor: Volume CO yang Diperlukan
Setelah mengetahui berapa banyak bijih yang diperlukan, langkah selanjutnya adalah menghitung pasokan gas reduktornya. Karbon monoksida harus disediakan dalam jumlah yang cukup agar reaksi dapat berjalan optimal. Perhitungan volume gas pada kondisi standar (STP: 0°C, 1 atm) memudahkan kita dalam perencanaan, karena volume gas sangat bergantung pada suhu dan tekanan. Sama seperti bijih, faktor efisiensi juga berlaku di sini, karena tidak semua gas CO yang dialirkan akan bereaksi sempurna; sebagian mungkin terbawa aliran atau bereaksi tidak lengkap.
Volume CO Teoritis dan Penyesuaian dengan Efisiensi
Berdasarkan persamaan Fe₃O₄ + 4 CO → 3 Fe + 4 CO₂, untuk menghasilkan 3 mol Fe dibutuhkan 4 mol CO. Pada kondisi STP, 1 mol gas menempati volume 22.4 liter. Untuk menghasilkan 5000 g Fe (≈ 89.53 mol, dari 5000/55.85), kebutuhan teoritis mol CO adalah (89.53 mol Fe)
– (4 mol CO / 3 mol Fe) ≈ 119.37 mol CO.
Volume teoritisnya di STP adalah 119.37 mol
– 22.4 L/mol ≈ 2674 liter atau 2.67 m³. Dengan efisiensi 88%, volume CO yang benar-benar harus disediakan akan lebih besar: 2.67 m³ / 0.88 ≈ 3.04 m³. Artinya, ada sekitar 0.37 m³ gas CO ekstra yang diperlukan untuk mengatasi ketidaksempurnaan proses.
| Parameter | Nilai Teoritis (100%) | Dengan Efisiensi 88% | Selisih |
|---|---|---|---|
| Volume CO pada STP | ≈ 2.67 m³ | ≈ 3.04 m³ | +0.37 m³ |
| Implikasi | Kebutuhan gas nyata di industri selalu lebih tinggi dari perhitungan ideal untuk mengatasi faktor praktis seperti kehilangan dan reaksi samping. | ||
Prosedur Lengkap Perhitungan Bahan Baku
Agar lebih jelas, mari kita rangkai semua langkah perhitungan dari awal hingga akhir dalam satu alur yang koheren. Prosedur ini dapat menjadi panduan praktis untuk perencanaan bahan baku di skala laboratorium maupun simulasi industri. Poin-poin kunci dari prosedur ini akan diringkas untuk penekanan.
Langkah Penentuan Massa Magnetit Akhir
- Tulis persamaan reaksi setara: Fe₃O₄ + 4 CO → 3 Fe + 4 CO₂.
- Hitung massa molar Fe₃O₄ (231.55 g/mol) dan Fe (55.85 g/mol).
- Tentukan massa besi target (5000 g) dan konversi ke mol: 5000 g / 55.85 g/mol ≈ 89.53 mol Fe.
- Berdasarkan stoikiometri (3 Fe dari 1 Fe₃O₄), hitung mol Fe₃O₄ teoritis: 89.53 mol Fe / 3 ≈ 29.84 mol.
- Hitung massa Fe₃O₄ teoritis: 29.84 mol
231.55 g/mol ≈ 6910 g (6.91 kg).
- Sesuaikan dengan efisiensi: Massa akhir = 6.91 kg / 0.88 ≈ 7.85 kg magnetit.
Langkah Penentuan Jumlah CO Akhir, Hitung fungsi CO dan massa magnetit untuk menghasilkan 5 kg besi (efisiensi 88 %)
- Gunakan mol Fe target yang sama (89.53 mol).
- Berdasarkan stoikiometri (4 CO untuk 3 Fe), hitung mol CO teoritis: 89.53 mol Fe
(4/3) ≈ 119.37 mol CO.
- Hitung volume teoritis pada STP (22.4 L/mol): 119.37 mol
22.4 L/mol ≈ 2674 L (2.67 m³).
- Sesuaikan dengan efisiensi: Volume akhir = 2.67 m³ / 0.88 ≈ 3.04 m³ gas CO pada STP.
Poin Penting Prosedur: 1) Selalu mulai dari persamaan reaksi setara. 2) Konversi semua massa ke mol untuk memudahkan perbandingan stoikiometri. 3) Faktor efisiensi diterapkan dengan membagi hasil teoritis dengan nilai desimal efisiensi. 4) Perhitungan volume gas harus memperhatikan kondisi (suhu, tekanan).
Faktor Praktis dan Aplikasi dalam Simulasi Industri
Perhitungan kita sejauh ini sudah memasukkan faktor efisiensi umum, tetapi dunia industri jauh lebih kompleks. Seorang perencana bahan baku harus mempertimbangkan variabel lain yang bisa menggeser angka-angka tersebut. Misalnya, bijih magnetit dari tambang tidak pernah 100% murni; ia bercampur dengan pengotor (gangue) seperti silika. Selain itu, kehilangan panas dari tungku, waktu tinggal (residence time) material yang tidak optimal, dan kualitas gas reduktor itu sendiri turut bermain.
Nah, kalau kita hitung fungsi CO dan massa magnetit untuk menghasilkan 5 kg besi dengan efisiensi 88%, prosesnya mirip strategi diplomasi: butuh perhitungan tepat dan komitmen kuat untuk hasil optimal. Ambisi membangun pengaruh ini juga terlihat dari Peran Aktif Indonesia di ASEAN sebagai Wujud Keinginan Menjadi Negara Berpengaruh , di mana kontribusi aktif adalah katalisnya. Sama halnya, dalam reaksi reduksi besi, CO yang tepat dan magnetit berkualitas adalah kunci mencapai target produksi yang diinginkan.
Menerapkan perhitungan ini dalam sebuah skenario membantu kita memahami dinamika nyatanya.
Variabel Praktis dan Studi Kasus Perencanaan
Selain efisiensi reaksi, variabel krusial lain termasuk kemurnian bijih (misalnya, hanya 90% Fe₃O₄), efisiensi pemanasan, dan potensi reaksi paralel yang mengonsumsi CO. Bayangkan sebuah pabrik pengolahan besi skala kecil (mini-blast furnace) merencanakan produksi batch 5 kg besi. Mereka tidak hanya perlu membeli 7.85 kg “magnetit”, tetapi mungkin 8.5 kg bijih mentah karena ada 10% pengotor. Kebutuhan CO 3.04 m³ di STP juga harus dikonversi ke kondisi operasi tunggu yang bersuhu tinggi, yang akan membutuhkan volume lebih besar secara fisik.
Studi kasus ini mengajarkan bahwa perhitungan stoikiometri adalah titik awal yang harus “dikotori” dengan asumsi-asumsi praktis untuk mendapatkan gambaran biaya dan logistik yang akurat.
Alur Material dari Bijih hingga Besi
Source: 123doks.com
Mari kita ikuti perjalanan material berdasarkan angka yang telah kita hitung. Awalnya, 7.85 kg bijih magnetit dimasukkan ke dalam reaktor. Gas CO dialirkan dengan volume setara 3.04 m³ pada kondisi standar. Di dalam tungku yang panas, gas CO menyerang struktur magnetit, mengikat atom-atom oksigen dan melepaskannya sebagai CO₂. Logam besi yang tertinggal lalu meleleh dan terkumpul di dasar tunggu.
Dari proses ini, dihasilkan 5 kg besi cair. Sisa material, berupa terak dari pengotor bijih dan gas buang CO₂, dipisahkan. Ilustrasi ini menunjukkan betapa perhitungan yang tampaknya kering di atas kertas sebenarnya adalah peta alur untuk sebuah transformasi material yang sangat nyata dan penuh energi.
Penutupan Akhir
Jadi, setelah melalui perjalanan hitung-menghitung yang detail, kita sampai pada kesimpulan yang konkret. Untuk mendapatkan 5 kg besi dengan efisiensi 88%, dibutuhkan sekitar 7.85 kg magnetit dan lebih dari 4000 liter gas CO pada kondisi STP. Angka-angka ini bukan akhir, melainkan titik awal yang kritis dalam perencanaan industri. Mereka menyoroti betapa pentingnya optimasi proses, karena setiap peningkatan efisiensi sekecil apa pun akan berdampak signifikan pada penghematan bahan baku, biaya produksi, dan jejak lingkungan.
Pada akhirnya, memahami hitungan ini adalah kunci untuk mengubah bijih yang inert menjadi logam yang berguna, merangkai sains dengan engineering dalam simfoni produksi yang efisien.
Kumpulan Pertanyaan Umum
Apakah perhitungan ini masih berlaku jika bijih besinya bukan magnetit murni?
Tidak. Perhitungan stoikiometri sangat bergantung pada komposisi kimia. Jika bijih mengandung pengotor atau mineral besi lain seperti hematit (Fe₂O₃), massa dan kebutuhan CO akan berubah. Analisis kandungan besi aktual dalam bijih (assay) harus dilakukan terlebih dahulu.
Mengapa efisiensinya hanya 88%, ke mana sisanya yang 12%?
Efisiensi 88% adalah contoh. “Kehilangan” 12% bisa disebabkan oleh banyak faktor praktis: gas CO yang tidak bereaksi sempurna dan terbuang, kehilangan panas, pembentukan slag (terak) yang masih mengandung besi, atau reaksi samping yang menghasilkan karbon dioksida (CO₂) sebelum CO sempat mereduksi bijih.
Bagaimana jika efisiensi proses berubah, misalnya menjadi 95% atau 75%?
Kebutuhan massa magnetit dan volume CO akan berbanding terbalik dengan efisiensi. Efisiensi lebih tinggi berarti kebutuhan bahan baku teoritis lebih mendekati kebutuhan nyata (lebih sedikit). Rumus penyesuaiannya: Kebutuhan Nyata = Kebutuhan Teoritis / (Efisiensi dalam desimal).
Apakah volume gas CO dihitung selalu pada kondisi STP (Standard Temperature and Pressure)?
Dalam perhitungan awal dan perbandingan teoritis, ya, STP (0°C, 1 atm) digunakan sebagai standar. Namun dalam operasi industri sesungguhnya, suhu dan tekanan sangat tinggi, sehingga volume aktual gas yang dialirkan akan berbeda. Perhitungan STP memberikan dasar untuk mengetahui jumlah molekul (mol) CO yang dibutuhkan.
Bisakah reduktor selain CO digunakan untuk proses ini?
Bisa. Gas hidrogen (H₂) juga dapat berfungsi sebagai reduktor dalam proses reduksi langsung (direct reduced iron). Bahkan karbon padat (kokas) adalah reduktor utama dalam tanur tinggi, yang kemudian menghasilkan CO secara in-situ untuk mereduksi bijih. Pemilihan reduktor tergantung teknologi dan ekonomi proses.