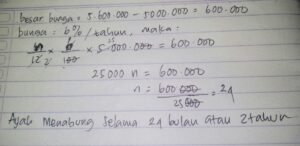Ion yang terbentuk saat MgNH4PO4 dilarutkan dalam air bukan sekadar daftar rumus kimia belaka, melainkan pintu masuk untuk memahami dinamika senyawa dalam larutan. Magnesium amonium fosfat, begitulah nama lengkapnya, mungkin terdengar asing di telinga awam, namun perannya dalam dunia kimia analitik dan industri cukup signifikan. Senyawa padat putih ini, ketika bertemu dengan pelarut universal bernama air, akan menjalani sebuah transformasi menarik di tingkat molekuler.
Proses pelarutannya mengikuti prinsip disosiasi ionik, di mana ikatan antar ion dalam kristal terputus oleh daya tarik molekul air yang polar. Hasilnya, partikel-partikel penyusun senyawa tersebut akan terlepas dan bergerak bebas dalam larutan, membawa muatan listrik masing-masing. Pemahaman mendalam tentang ion-ion apa saja yang muncul dari proses ini menjadi kunci untuk menguak sifat larutan yang terbentuk serta penerapannya dalam berbagai konteks praktis.
Pengenalan Senyawa MgNH4PO4: Ion Yang Terbentuk Saat MgNH4PO4 Dilarutkan Dalam Air
Dalam dunia kimia, khususnya analisis anorganik, terdapat senyawa yang mungkin terdengar rumit namun memegang peran penting: magnesium amonium fosfat. Senyawa dengan rumus kimia MgNH4PO4 ini adalah padatan kristalin yang sering menjadi bintang utama dalam identifikasi kation magnesium. Secara struktural, ia merupakan garam rangkap tiga yang terdiri dari kation magnesium (Mg²⁺), kation amonium (NH₄⁺), dan anion fosfat (PO₄³⁻). Ketiga ion ini terikat bersama dalam suatu kisi kristal yang rapi.Senyawa ini umumnya berwarna putih, berbentuk serbuk halus atau kristal, dan memiliki sifat yang cukup khas: kelarutannya yang sangat rendah dalam air netral.
Namun, kelarutannya meningkat secara signifikan dalam lingkungan asam. Sifat inilah yang menjadi kunci dalam banyak aplikasinya. Kamu akan sering menemukan nama senyawa ini dalam buku-buku teks kimia analitik, khususnya pada pembahasan tentang analisis kualitatif dan kuantitatif golongan kation, serta dalam konteks ilmu tanah dan kimia pupuk, karena terkait dengan keberadaan unsur hara magnesium dan fosfor.
Proses Pelarutan dan Disosiasi
Source: slidesharecdn.com
Ketika kristal MgNH4PO4 yang padat bertemu dengan air, sebuah proses menarik terjadi pada tingkat molekuler. Air, sebagai pelarut polar, mulai menyerang permukaan kristal. Molekul-molekul air mengorientasikan diri dengan kutub positif (H) menghadap anion fosfat (PO₄³⁻) dan kutub negatif (O) menghadap kation magnesium (Mg²⁺) dan amonium (NH₄⁺). Interaksi elektrostatik ini melemahkan gaya tarik-menarik yang mengikat ion-ion dalam kisi kristal, sehingga satu per satu ion terlepas dan dikelilingi oleh molekul air.Proses pelepasan ion ini disebut disosiasi.
Dalam kasus MgNH4PO4 yang terlarut sempurna, kristalnya akan terurai sepenuhnya menjadi ion-ion penyusunnya yang bebas bergerak dalam larutan. Tidak ada molekul MgNH4PO4 yang utuh tersisa dalam larutan. Ion-ion yang terbentuk dapat diidentifikasi dengan jelas sebagai berikut:
| No. | Nama Ion | Rumus Ion | Muatan |
|---|---|---|---|
| 1. | Ion Magnesium | Mg²⁺ | +2 |
| 2. | Ion Amonium | NH₄⁺ | +1 |
| 3. | Ion Fosfat | PO₄³⁻ | -3 |
Analisis Spesies Ionik dalam Larutan
Setelah terlepas dari kisi kristal, ion-ion tersebut tidak benar-benar “bebas”. Mereka segera mengalami hidrasi, yaitu dikelilingi oleh selubung molekul air yang terikat secara elektrostatik. Ion Mg²⁺ yang bermuatan +2 akan menarik molekul air melalui atom oksigennya, membentuk ion terhidrasi [Mg(H₂O)₆]²⁺. Sementara itu, ion NH₄⁺ dapat membentuk ikatan hidrogen dengan air melalui atom hidrogennya. Anion PO₄³⁻ yang bermuatan -3 kuat akan menarik molekul air melalui atom hidrogennya.Dalam larutan air, terutama yang tidak benar-benar encer, anion fosfat (PO₄³⁻) merupakan basa kuat dan dapat mengalami protonasi sebagian oleh air.
Oleh karena itu, selain ion PO₄³⁻, mungkin juga terdapat spesies lain seperti ion hidrogen fosfat (HPO₄²⁻) dan dihidrogen fosfat (H₂PO₄⁻), tergantung pada pH larutan. Keseimbangan antara spesies-spesies fosfat ini sangat mempengaruhi kelarutan MgNH4PO4 itu sendiri.Faktor-faktor yang mempengaruhi kestabilan ion-ion hasil disosiasi dalam larutan antara lain:
- pH Larutan: pH sangat menentukan bentuk spesies fosfat yang dominan (PO₄³⁻, HPO₄²⁻, atau H₂PO₄⁻). Pada pH basa, PO₄³⁻ lebih stabil, sedangkan pada pH asam, bentuk terprotonasi yang mendominasi.
- Konsentrasi Ion: Konsentrasi ion Mg²⁺, NH₄⁺, dan PO₄³⁻ yang tinggi dapat mendorong reaksi kebalikan, yaitu pengendapan kembali membentuk MgNH4PO4 padat.
- Suhu: Peningkatan suhu umumnya meningkatkan energi kinetik ion dan proses hidrasi, sehingga dapat mempengaruhi tingkat kelarutan dan kestabilan ion dalam larutan.
- Keberadaan Ion Lain: Ion asing dapat memberikan efek ion senama yang menekan kelarutan, atau membentuk kompleks dengan salah satu ion (misalnya Mg²⁺ membentuk kompleks dengan EDTA) yang justru meningkatkan kelarutan.
Persamaan Reaksi dan Konstanta Kesetimbangan
Pelarutan dan disosiasi sempurna MgNH4PO4 dapat direpresentasikan dengan sebuah persamaan reaksi kimia yang sederhana namun padat makna. Persamaan ini menggambarkan transisi senyawa dari fasa padat ke fasa terlarut sebagai ion-ionnya.
MgNH4PO4(s) ⇌ Mg²⁺(aq) + NH₄⁺(aq) + PO₄³⁻(aq)
Simbol (s) menunjukkan keadaan padat (solid), sedangkan (aq) menunjukkan ion yang terlarut dan terhidrasi dalam air (aqueous). Panah dua arah (⇌) sangat krusial karena menunjukkan bahwa ini adalah reaksi kesetimbangan dinamis. Pada titik tertentu, laju pelarutan kristal sama dengan laju pengendapan kembali ion-ion menjadi kristal. Untuk mengkuantifikasi kesetimbangan ini, digunakan konsep Hasil Kali Kelarutan (Ksp). Ksp adalah konstanta kesetimbangan khusus untuk kelarutan senyawa ionik sukar larut.
Ksp MgNH4PO4 = [Mg²⁺][NH₄⁺][PO₄³⁻]
Ketika MgNH4PO4 dilarutkan dalam air, senyawa ini akan terdisosiasi menjadi ion magnesium (Mg²⁺), ion amonium (NH₄⁺), dan ion fosfat (PO₄³⁻). Proses pelarutan ini, meski tampak instan, terjadi dalam skala waktu yang sangat singkat—sebuah konsep yang mengingatkan kita pada perhitungan satuan waktu geologis seperti yang dijelaskan dalam ulasan Satu Mikroabad Kira‑kira Setara Dengan Berapa. Namun, fokus kita tetap pada dinamika ion-ion tersebut dalam larutan, di mana interaksi antar ion menentukan sifat kimiawi akhir dari sistem yang diamati.
Ekspresi Ksp di atas menyatakan bahwa pada suhu tertentu, hasil kali konsentrasi molar ion-ion penyusunnya (dipangkatkan dengan koefisiennya), dalam keadaan jenuh, adalah sebuah nilai konstan. Nilai Ksp MgNH4PO4 yang kecil (sekitar 2.5 × 10⁻¹³) mengkonfirmasi sifatnya yang sukar larut. Jika hasil kali konsentrasi ion-ion dalam larutan ([Mg²⁺][NH₄⁺][PO₄³⁻]) melebihi nilai Ksp-nya, maka endapan MgNH4PO4 akan terbentuk.
Aplikasi dan Implikasi Kimia
Pemahaman mendalam tentang ion-ion hasil pelarutan MgNH4PO4 bukan sekadar teori, melainkan fondasi dari aplikasi praktis yang sangat berguna. Dalam analisis kualitatif kation golongan V (golongan magnesium-natrium), pembentukan endapan putih kristalin MgNH4PO4 adalah uji konfirmasi yang khas untuk keberadaan ion Mg²⁺. Prosedur ini melibatkan penambahan larutan natrium fosfat (Na₃PO₄) dan amonia (NH₃) ke dalam larutan sampel yang diduga mengandung magnesium.Visualisasi prosesnya cukup menarik.
Awalnya, larutan sampel yang jernih, setelah ditetesi reagen, akan mulai tampak keruh seperti kabut halus (turbiditas). Kabut halus ini kemudian dengan cepat berkumpul membentuk endapan putih yang menggumpal halus dan mengendap di dasar tabung reaksi. Endapan ini, jika diamati di bawah mikroskop, mungkin menunjukkan struktur kristal berbentuk prisma atau daun. Ketika endapan ini kemudian dilarutkan kembali dengan menambahkan asam (misalnya HCl), kita menyaksikan proses kebalikannya: endapan putih lenyap seketika, kembali menjadi larutan jernih.
Ini terjadi karena ion H⁺ dari asam mengikat PO₄³⁻ membentuk HPO₄²⁻ atau H₂PO₄⁻, sehingga hasil kali ion menjadi jauh di bawah nilai Ksp dan kesetimbangan bergeser kuat ke arah ion terlarut. Siklus pengendapan dan pelarutan ini adalah demonstrasi langsung dan elegan dari prinsip-prinsip kelarutan dan hasil kali kelarutan yang telah dibahas.
Ringkasan Terakhir
Dengan demikian, menelusuri ion-ion hasil pelarutan MgNH4PO4 membawa kita pada apresiasi yang lebih dalam tentang elegannya hukum kimia dalam aksi. Dari sebutir kristal yang larut hingga interaksi rumit di antara ion-ion terhidrasi, setiap tahapannya memiliki cerita dan implikasi tersendiri. Pengetahuan ini tidak berhenti di teori, melainkan menjadi fondasi bagi teknik analisis di laboratorium dan proses industri, membuktikan bahwa hal-hal mendasar seringkali justru paling aplikatif.
Memahami proses di balik layar ini memungkinkan kita untuk tidak hanya melihat larutan sebagai campuran, tetapi sebagai sebuah ekosistem ionik yang dinamis dan penuh makna.
Ketika magnesium amonium fosfat (MgNH₄PO₄) dilarutkan dalam air, senyawa ini akan terdisosiasi menjadi ion-ion penyusunnya, yaitu Mg²⁺, NH₄⁺, dan PO₄³⁻. Proses kimia ini, meski terlihat teknis, memiliki ritme tersendiri layaknya komposisi musik, di mana notasi yang tepat sangat krusial, seperti halnya membutuhkan panduan Tolong Beri Nomor Lagu Fur Elise untuk Pianika untuk menghasilkan melodi yang harmonis. Demikian pula, pemahaman tentang interaksi ion-ion tersebut dalam larutan menjadi kunci untuk menganalisis reaksi presipitasi lebih lanjut.
Ringkasan FAQ
Apakah larutan MgNH4PO4 bersifat asam, basa, atau netral?
Saat magnesium amonium fosfat (MgNH₄PO₄) dilarutkan dalam air, senyawa ini terurai menjadi ion-ion Mg²⁺, NH₄⁺, dan PO₄³⁻. Fenomena perubahan kimiawi ini, meski tak kasatmata, mengingatkan pada adaptasi luar biasa di alam, sebagaimana Bunglon mengubah warna tubuhnya agar tidak terlihat pemangsa. Sama halnya, keberadaan ion-ion tersebut dalam larutan adalah bentuk “penyamaran” molekuler yang stabil, sebuah keseimbangan dinamis yang menjadi fondasi dalam analisis kimia kuantitatif dan pemahaman sifat elektrolit.
Larutan MgNH4PO4 cenderung bersifat sedikit basa. Ion amonium (NH4+) bersifat asam lemah, sedangkan ion fosfat (PO4^3-) adalah basa lemah. Namun, karena hidrolisis ion fosfat lebih dominan, pH larutan akhir akan sedikit di atas 7.
Bisakah ion-ion tersebut bergabung kembali membentuk endapan?
Ya, sangat mungkin. Ion Mg2+, NH4+, dan PO4^3- dapat bergabung kembali membentuk endapan MgNH4PO4 jika konsentrasi mereka melebihi nilai hasil kali kelarutan (Ksp) senyawa tersebut. Proses ini sering dimanfaatkan dalam analisis kualitatif untuk mengidentifikasi ion magnesium.
Mengapa penting mengetahui muatan setiap ion yang terbentuk?
Mengetahui muatan ion sangat penting untuk memprediksi sifat larutan (seperti daya hantar listrik), memahami kekuatan interaksi elektrostatik dengan molekul air (hidrasi), serta meramalkan reaksi lebih lanjut seperti pembentukan kompleks atau pengendapan dengan ion lain.
Adakah gas yang dilepaskan saat MgNH4PO4 dilarutkan?
Tidak, dalam kondisi normal pelarutan MgNH4PO4 dalam air murni tidak melepaskan gas. Prosesnya murni disosiasi ionik menjadi ion-ion yang larut. Pelepasan gas amonia (NH3) mungkin terjadi jika larutan dipanaskan atau dalam kondisi yang sangat basa.