Massa Molekul Relatif Na₂SO₄·5H₂O bukan sekadar angka dalam tabel periodik, melainkan kunci untuk memahami karakter unik dari garam Glauber, senyawa yang akrab dalam dunia kimia dan industri. Perhitungannya yang tampak teknis justru membuka wawasan tentang bagaimana molekul air terikat dalam struktur kristal, memberikan sifat fisika yang khas dan aplikasi yang luas. Mari kita selami lebih dalam untuk mengungkap rahasia di balik angka massa molekul tersebut.
Dalam perhitungannya, kita tidak hanya menjumlahkan massa atom natrium, sulfur, dan oksigen dari bagian anhidratnya, tetapi juga harus secara cermat memasukkan kontribusi dari lima molekul air hidrasi. Proses ini mengajarkan ketelitian karena setiap atom, termasuk hidrogen dan oksigen dari air kristal, memberi pengaruh signifikan terhadap massa total. Pemahaman ini sangat krusial, terutama dalam percobaan laboratorium yang melibatkan penimbangan dan reaksi stoikiometri yang presisi.
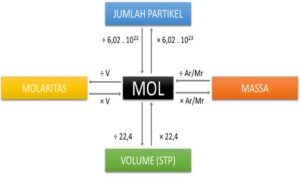
Pengertian dan Konsep Dasar Massa Molekul Relatif (Mr)
Dalam dunia kimia, memahami berat suatu senyawa adalah hal mendasar. Konsep ini diwakili oleh Massa Molekul Relatif (Mr), sebuah besaran yang menunjukkan perbandingan massa rata-rata satu molekul suatu senyawa terhadap 1/12 massa atom karbon-12. Seringkali, Mr disamakan dengan Massa Atom Relatif (Ar), padahal keduanya memiliki cakupan yang berbeda. Ar adalah massa relatif satu atom suatu unsur, sementara Mr adalah penjumlahan dari seluruh Ar atom-atom penyusun sebuah molekul.
Dengan kata lain, Ar adalah bahan bakunya, sedangkan Mr adalah berat total produk jadinya.
Perhitungan Mr dilakukan dengan cara yang sistematis: identifikasi semua unsur penyusun senyawa, cari nilai Ar masing-masing unsur dari tabel periodik, kalikan Ar setiap unsur dengan jumlah atomnya dalam rumus kimia, dan terakhir, jumlahkan semua hasil perkalian tersebut. Untuk senyawa hidrat, yang mengandung molekul air terikat dalam struktur kristalnya (ditandai dengan tanda titik seperti ·nH₂O), perhitungannya mencakup pula massa dari molekul air tersebut.
Sebelum membahas senyawa yang lebih kompleks, mari kita lihat contoh sederhana. Air (H₂O) memiliki Mr = (2 x Ar H) + (1 x Ar O) = (2 x 1) + 16 = 18. Karbon dioksida (CO₂) memiliki Mr = (1 x Ar C) + (2 x Ar O) = 12 + (2 x 16) = 44.
Perbandingan Konsep Massa dalam Kimia, Massa Molekul Relatif Na₂SO₄·5H₂O

Source: quipper.com
Untuk memperjelas perbedaan dan hubungan antara berbagai konsep massa dalam kimia, tabel berikut menyajikan perbandingannya secara langsung.
| Konsep | Definisi | Hubungan dengan Besaran Lain | Satuan |
|---|---|---|---|
| Massa Atom Relatif (Ar) | Massa rata-rata satu atom suatu unsur relatif terhadap 1/12 massa atom C-12. | Nilai tetap untuk setiap unsur (lihat tabel periodik). | Tidak bersatuan (angka relatif). |
| Massa Molekul Relatif (Mr) | Jumlah total Ar dari semua atom dalam satu molekul senyawa. | Mr = Σ (Jumlah atom tiap unsur × Ar unsur). | Tidak bersatuan (angka relatif). |
| Massa Molar (M) | Massa satu mol zat, yang secara numerik sama dengan Ar (untuk unsur) atau Mr (untuk senyawa). | M = Mr g/mol atau M = Ar g/mol. | Gram per mol (g/mol). |
Memahami Senyawa Hidrat Natrium Sulfat Dekahidrat
Dalam konteks artikel ini, terdapat koreksi nomenklatur yang penting. Senyawa yang dimaksud dengan rumus Na₂SO₄·5H₂O lebih tepat disebut natrium sulfat pentahidrat. Namun, senyawa natrium sulfat yang paling umum dikenal dalam praktikum justru adalah natrium sulfat dekahidrat, dengan rumus Na₂SO₄·10H₂O. Senyawa ini juga dikenal dengan nama garam Glauber, diambil dari nama penemunya, Johann Rudolf Glauber. Perbedaan jumlah molekul air ini sangat signifikan karena mempengaruhi massa, sifat, dan aplikasinya.
Menghitung massa molekul relatif Na₂SO₄·5H₂O, atau natrium sulfat dekahidrat, memerlukan penjumlahan yang teliti dari seluruh atom penyusunnya. Proses ini mengingatkan kita bahwa dalam sains, seperti dalam kehidupan, kolaborasi yang efektif adalah kunci. Prinsip ini juga berlaku dalam berbagai Bentuk‑bentuk Kerja Sama yang kompleks, di mana setiap pihak berkontribusi layaknya atom dalam molekul. Dengan demikian, pemahaman mendalam tentang struktur dan interaksi dalam senyawa ini pun menjadi lebih bermakna, mencerminkan harmoni dari sebuah kerja sama yang solid.
Senyawa Na₂SO₄·10H₂O tersusun dari bagian anhidrat, yaitu natrium sulfat (Na₂SO₄) yang terdiri dari kation natrium (Na⁺) dan anion sulfat (SO₄²⁻), serta sepuluh molekul air (H₂O) yang terikat secara koordinasi dalam kisi kristal. Molekul-molekul air ini bukan sekadar pelengkap; mereka menempati posisi spesifik dalam struktur kristal dan membentuk ikatan hidrogen dengan ion sulfat, yang menstabilkan bentuk kristal tertentu pada suhu ruang.
Sifat Fisika Utama Natrium Sulfat Dekahidrat
Senyawa hidrat ini memiliki karakteristik fisika yang mudah dikenali, yang banyak dimanfaatkan dalam laboratorium dan industri.
- Wujud dan Penampilan: Berbentuk padatan kristalin, biasanya berupa kristal transparan tak berwarna atau berwarna putih.
- Kelarutan: Mudah larut dalam air. Kelarutannya memiliki sifat yang menarik karena sangat bergantung pada suhu, meningkat drastis di atas suhu tertentu.
- Stabilitas: Pada suhu dan kelembaban ruang yang stabil, senyawa ini dapat bertahan. Namun, di udara terbuka yang kering, ia dapat secara perlahan kehilangan air kristalnya dan berubah menjadi bubuk anhidrat berwarna putih (efflorescence).
Prosedur Perhitungan Massa Molekul Relatif Na₂SO₄·10H₂O
Menghitung Mr senyawa hidrat seperti Na₂SO₄·10H₂O memerlukan ketelitian ekstra karena kita harus memperhitungkan semua atom dari bagian garam anhidrat dan juga semua atom dari molekul air kristalnya. Langkah-langkahnya tetap mengikuti prinsip dasar: kalikan jumlah atom dengan Ar-nya, lalu jumlahkan semuanya. Untuk memudahkan, penyusunan data dalam tabel sangat disarankan.
Perhitungan Massa Molekul Relatif Na₂SO₄·5H₂O, atau natrium sulfat dekahidrat, memerlukan ketelitian dalam menjumlahkan massa atom setiap unsur dan molekul airnya. Proses berpikir sistematis ini serupa dengan merangkai ide menggunakan Kata Penghubung dalam Kalimat Berangkat Sekolah Pukul 6 Bersama Ayah , di mana konjungsi berperan penting membangun alur logika. Dengan demikian, pemahaman mendalam tentang struktur dan hubungan antar komponen, baik dalam senyawa kimia maupun kalimat, menjadi kunci utama analisis yang akurat.
Rincian Perhitungan Unsur Penyusun
Berikut adalah tabel yang merinci kontribusi setiap atom terhadap total Mr senyawa natrium sulfat dekahidrat. Nilai Ar yang digunakan adalah berdasarkan data IUPAC terkini (C = 12,01 sebagai standar).
| Unsur | Jumlah Atom | Ar | Total Kontribusi (Jumlah Atom × Ar) |
|---|---|---|---|
| Natrium (Na) | 2 | 22,99 | 45,98 |
| Sulfur (S) | 1 | 32,06 | 32,06 |
| Oksigen (dalam SO₄) | 4 | 16,00 | 64,00 |
| Hidrogen (dalam 10H₂O) | 20 | 1,01 | 20,20 |
| Oksigen (dalam 10H₂O) | 10 | 16,00 | 160,00 |
| Total Massa Molekul Relatif (Mr) | 322,24 | ||
Dari perhitungan tersebut, kita dapat melihat betapa signifikannya kontribusi air kristal. Sebagai perbandingan:
Mr Na₂SO₄ (anhidrat) = (2×22,99) + 32,06 + (4×16,00) = 142,04
Mr Na₂SO₄·10H₂O (hidrat) = 142,04 + (10×18,02) = 322,24Perhitungan Massa Molekul Relatif Na₂SO₄·5H₂O, yang melibatkan penjumlahan massa atom dan molekul air kristal, memerlukan ketelitian layaknya sebuah proyek konstruksi. Prinsip perbandingan terbalik dalam menghitung tambahan pekerja untuk menyelesaikan gedung dalam 32 hari ini sebenarnya memiliki benang merah dengan stoikiometri, di mana setiap variabel—seperti jumlah pekerja atau molekul air—harus diperhitungkan secara presisi untuk mendapatkan hasil yang akurat, termasuk dalam menentukan massa senyawa hidrat tersebut.
Perhitungan yang akurat ini menjadi kunci dalam stoikiometri. Misalnya, jika suatu prosedur membutuhkan 1 mol Na₂SO₄, maka menimbang 142,04 gram senyawa anhidrat atau 322,24 gram senyawa dekahidrat akan memberikan jumlah partikel Na₂SO₄ yang sama. Kesalahan mengabaikan air kristal akan menyebabkan kesalahan penimbangan lebih dari dua kali lipat.
Aplikasi dan Relevansi dalam Percobaan Laboratorium: Massa Molekul Relatif Na₂SO₄·5H₂O
Konsep Mr senyawa hidrat tidak hanya teori, tetapi langsung diaplikasikan dalam percobaan laboratorium klasik: penentuan kadar air dalam suatu senyawa hidrat. Percobaan ini mengandalkan prinsip bahwa pemanasan akan mengusir molekul air kristal, menyisakan senyawa anhidrat yang lebih ringan. Selisih massa sebelum dan sesudah pemanasan langsung merepresentasikan massa air yang hilang.
Prosedur singkatnya adalah: timbang massanya, panaskan sampel hidrat secara kuat dan konstan hingga massanya tetap, timbang kembali massanya. Persentase air dapat dihitung dengan rumus: (Massa air yang hilang / Massa sampel awal) × 100%. Proses penghilangan air ini disebut dehidrasi, dan senyawa padatan yang dihasilkan setelah air kristal hilang disebut senyawa anhidrat.
Ilustrasi Perubahan pada Pemanasan dan Data Perbandingan
Ketika Na₂SO₄·10H₂O dipanaskan, terjadi transformasi yang dramatis. Kristal-kristal bening yang besar akan meleleh terlebih dahulu pada suhu sekitar 32°C karena air kristalnya larut (senyawa hidrat memiliki titik lelehnya sendiri). Pemanasan berlanjut akan mendidihkan air tersebut dan akhirnya meninggalkan bubuk putih halus yang merupakan Na₂SO₄ anhidrat. Perubahan dari zat kristalin transparan menjadi bubuk putih kapur ini adalah ilustrasi visual yang jelas dari proses dehidrasi.
| Nama Senyawa Hidrat | Rumus | Massa Sebelum Dipanaskan (contoh) | Massa Setelah Dipanaskan (contoh) | Massa Air yang Hilang |
|---|---|---|---|---|
| Tembaga(II) Sulfat Pentahidrat | CuSO₄·5H₂O | 2.50 g | 1.60 g | 0.90 g |
| Kalsium Sulfat Dihidrat (Gipsum) | CaSO₄·2H₂O | 1.72 g | 1.36 g | 0.36 g |
Latihan dan Penerapan pada Senyawa Hidrat Lainnya
Kemampuan menghitung Mr senyawa hidrat dapat diasah dengan menerapkannya pada berbagai senyawa. Variasi jumlah molekul air dalam senyawa hidrat bergantung pada beberapa faktor, seperti ukuran dan muatan ion pusat, serta kemampuan ion tersebut untuk berikatan dengan molekul air melalui koordinasi atau ikatan hidrogen. Ion-ion dengan muatan tinggi dan ukuran kecil biasanya memiliki gaya tarik yang lebih kuat terhadap air.
Soal Latihan Bertingkat
Berikut tiga soal untuk menguji pemahaman, dengan tingkat kesulitan yang meningkat.
- Mudah: Hitung Mr dari magnesium sulfat heptahidrat, MgSO₄·7H₂O. (Ar: Mg=24,31, S=32,06, O=16,00, H=1,01).
- Sedang: Jika suatu sampel kobalt(II) klorida heksahidrat (CoCl₂·6H₂O) memiliki massa 5.00 gram, hitung massa air yang terkandung di dalamnya.
- Sulit: Suatu senyawa hidrat besi(II) sulfat memiliki rumus FeSO₄·xH₂O. Percobaan menunjukkan bahwa persentase massa air dalam senyawa tersebut adalah 45.3%. Tentukan nilai x (bilangan bulat). (Ar: Fe=55,85).
Langkah Pengecekan dan Analisis Komparatif
Sebelum menyimpulkan hasil perhitungan Mr, terutama untuk senyawa dengan banyak atom, ada beberapa poin kunci yang perlu diperiksa kembali: pastikan rumus kimia ditulis dengan benar, termasuk titik hidrasinya; pastikan jumlah atom setiap unsur sudah dihitung dengan teliti (ingat indeks di dalam dan di luar kurung); gunakan nilai Ar dengan ketelitian yang konsisten; dan terakhir, lakukan penjumlahan akhir dengan cermat.
Sebagai contoh analisis, mari hitung persentase massa air dalam dua senyawa hidrat dan bandingkan.
- Na₂SO₄·10H₂O: Mr total = 322,24. Massa 10H₂O = 180,20. % H₂O = (180,20 / 322,24) × 100% = 55,92%.
- MgSO₄·7H₂O: Mr total = 246,48. Massa 7H₂O = 126,14. % H₂O = (126,14 / 246,48) × 100% = 51,17%.
Perbandingan ini menunjukkan bahwa meskipun MgSO₄·7H₂O memiliki jumlah molekul air yang lebih sedikit, persentase massanya tidak jauh berbeda karena Mr bagian anhidrat MgSO₄ (120,37) juga lebih kecil dibandingkan Na₂SO₄ (142,04). Hal ini menegaskan bahwa analisis harus selalu melihat pada keseluruhan komposisi, bukan hanya jumlah molekul airnya.
Ringkasan Penutup
Dengan demikian, menguasai perhitungan Massa Molekul Relatif untuk senyawa hidrat seperti Na₂SO₄·5H₂O adalah fondasi penting dalam kimia praktis. Konsep ini bukan hanya teori belaka, tetapi langsung terhubung dengan kemampuan kita untuk menentukan kemurnian zat, merancang percobaan yang akurat, dan memahami perilaku materi di sekitar kita. Dari laboratorium sekolah hingga aplikasi industri, pemahaman mendalam tentang air kristal dan kontribusinya terhadap massa membekali kita dengan alat analisis yang sangat berharga.
Panduan Pertanyaan dan Jawaban
Mengapa angka 5 dalam Na₂SO₄·5H₂O ditulis dengan titik dan bukan tanda tambah?
Titik (·) dalam rumus kimia senyawa hidrat bukanlah tanda perkalian, melainkan simbol yang menunjukkan bahwa molekul air (H₂O) terikat secara fisik dalam struktur kristal senyawa tersebut, bukan melalui ikatan kimia kovalen yang kuat seperti antar atom dalam molekul Na₂SO₄.
Apakah massa molekul relatif (Mr) sama dengan massa molar?
Secara numerik, angkanya sama. Namun, Mr adalah bilangan tanpa satuan (relatif terhadap atom C-12), sedangkan massa molar memiliki satuan gram per mol (g/mol). Mr menyatakan perbandingan massa, sementara massa molar menyatakan massa satu mol zat.
Bagaimana jika senyawa hidrat seperti Na₂SO₄·5H₂O terkena udara terbuka? Apakah massanya berubah?
Ya, bisa berubah. Beberapa senyawa hidrat bersifat higroskopis (menyerap air) atau efloresen (melepaskan air). Na₂SO₄·10H₂O (dekahidrat) yang lebih umum dikenal dapat kehilangan air kristal di udara kering, sehingga massanya berkurang dan berubah menjadi bentuk anhidrat atau hidrat dengan molekul air lebih sedikit.
Apakah semua senyawa dapat membentuk senyawa hidrat?
Tidak. Hanya senyawa ionik tertentu, terutama garam, yang memiliki struktur kristal yang mampu mengakomodasi dan mengikat molekul air dalam rongga kisi kristalnya. Senyawa kovalen murni umumnya tidak membentuk hidrat dengan pola yang sama.