Menghitung Massa Zat: Glukosa, Natrium, Metana, Nitrogen, Sulfur Dioksida bukan sekadar angka-angka di kertas, melainkan kunci untuk membuka pemahaman tentang dunia di sekitar kita. Dari gula dalam secangkir teh hingga gas alam yang menghangatkan rumah, setiap zat memiliki cerita massa yang unik. Pemahaman ini menjadi fondasi bagi siapa saja yang ingin mendalami ilmu kimia, baik untuk keperluan akademik maupun aplikasi praktis dalam kehidupan sehari-hari.
Perhitungan massa zat berangkat dari konsep mendasar massa atom dan molekul relatif. Dengan memahami bagaimana atom-atom seperti karbon, hidrogen, dan oksigen menyatu membentuk senyawa kompleks seperti glukosa, atau bagaimana unsur-unsur seperti natrium berdiri sendiri, kita dapat mengkuantifikasi materi secara tepat. Proses ini melibatkan logika matematika yang sederhana namun powerful, menghubungkan dunia mikroskopis partikel dengan dunia makroskopis yang dapat kita ukur dan rasakan.
Konsep Dasar dan Rumus Perhitungan Massa
Memahami massa suatu zat merupakan fondasi dalam ilmu kimia, baik untuk keperluan eksperimen di laboratorium maupun analisis dalam industri. Konsep ini berakar pada pemahaman tentang massa atom dan molekul, yang karena ukurannya yang sangat kecil, diukur secara relatif. Perhitungan massa tidak lepas dari hubungannya dengan konsep mol, yang menjembatani dunia mikroskopis atom dengan dunia makroskopis yang dapat kita ukur.
Massa Atom Relatif dan Massa Molekul Relatif, Menghitung Massa Zat: Glukosa, Natrium, Metana, Nitrogen, Sulfur Dioksida
Massa atom relatif (Ar) adalah massa rata-rata satu atom suatu unsur yang dibandingkan dengan 1/12 massa satu atom karbon-12. Angka ini tidak bersatuan dan dapat ditemukan pada tabel periodik. Sementara itu, massa molekul relatif (Mr) adalah jumlah total Ar dari semua atom penyusun suatu molekul senyawa. Mr memberikan gambaran tentang seberapa berat suatu molekul jika dibandingkan dengan standar yang sama.
Rumus utama yang menghubungkan massa (m), jumlah mol (n), dan Mr adalah: m = n × Mr. Dalam persamaan ini, massa (m) biasanya dinyatakan dalam gram (g), dan Mr dalam gram per mol (g/mol).
Berikut tabel perbandingan untuk memperjelas konsep dasar tersebut.
| Konsep | Simbol | Definisi | Satuan Pengukuran |
|---|---|---|---|
| Massa Atom Relatif | Ar | Massa rata-rata satu atom unsur relatif terhadap 1/12 atom C-12. | Tidak bersatuan (angka relatif) |
| Massa Molekul Relatif | Mr | Jumlah total Ar dari semua atom dalam satu molekul senyawa. | Tidak bersatuan (angka relatif) |
| Massa Molar | M | Massa satu mol zat, nilainya sama dengan Ar atau Mr. | Gram per mol (g/mol) |
| Massa | m | Banyaknya materi yang terkandung dalam suatu zat. | Gram (g), kilogram (kg), miligram (mg) |
Sebagai contoh perhitungan sederhana, mari kita tentukan massa molar unsur natrium (Na). Dari tabel periodik, diketahui Ar Na = 23. Artinya, massa satu mol atom natrium adalah 23 gram. Jadi, jika kita memiliki 2 mol natrium, massanya adalah m = n × Ar = 2 mol × 23 g/mol = 46 gram.
Perhitungan massa zat seperti glukosa, natrium, metana, nitrogen, dan sulfur dioksida memerlukan ketelitian dan pemahaman konsep yang kokoh. Dalam ranah spiritual, pencarian akan pemahaman yang absolut juga hadir, misalnya ketika kita berusaha Jelaskan makna As Samad sebagai salah satu sifat Allah yang Maha Mandiri. Kembali ke laboratorium, ketepatan dalam menghitung massa molekul atau atom zat-zat tersebut adalah fondasi utama bagi berbagai eksperimen dan aplikasi industri yang lebih luas.
Analisis Komponen dan Massa Unsur Penyusun
Setelah memahami konsep dasar, langkah selanjutnya adalah menerapkannya pada senyawa spesifik. Dengan mengidentifikasi atom-atom penyusunnya, kita dapat menghitung massa molekul relatif dan bahkan mengetahui kontribusi massa setiap unsur dalam senyawa tersebut. Analisis ini penting, misalnya, dalam menentukan kemurnian bahan atau merancang formula suatu produk.
Identifikasi Atom dan Perhitungan Mr
Kelima zat yang dibahas memiliki komposisi yang berbeda-beda. Glukosa merupakan senyawa organik kompleks dengan rumus C₆H₁₂O₆. Natrium (Na) adalah unsur logam yang berdiri sendiri sebagai atom. Metana (CH₄) adalah hidrokarbon gas yang sederhana. Nitrogen (N₂) umum ditemukan sebagai molekul diatomik di udara.
Sulfur dioksida (SO₂) adalah gas berbau tajam hasil pembakaran belerang.
Perhitungan Mr dilakukan dengan menjumlahkan Ar semua atom dalam rumus kimia. Berikut langkah-langkah rincinya:
- Glukosa (C₆H₁₂O₆): Mr = (6 × Ar C) + (12 × Ar H) + (6 × Ar O) = (6×12) + (12×1) + (6×16) = 72 + 12 + 96 = 180.
- Natrium (Na): Karena unsur, Mr = Ar Na = 23.
- Metana (CH₄): Mr = (1 × Ar C) + (4 × Ar H) = 12 + 4 = 16.
- Nitrogen (N₂): Mr = (2 × Ar N) = 2 × 14 = 28.
- Sulfur Dioksida (SO₂): Mr = (1 × Ar S) + (2 × Ar O) = 32 + (2×16) = 64.
Kontribusi Massa Unsur dalam Glukosa
Dalam molekul glukosa, setiap jenis atom memberikan porsi massa yang berbeda. Memahami komposisi ini berguna untuk berbagai analisis, seperti menghitung nilai kalori atau dalam proses fermentasi.
- Atom Karbon (C): Terdapat 6 atom. Total kontribusi massa = 6 × 12 = 72 satuan massa atom.
- Atom Hidrogen (H): Terdapat 12 atom. Total kontribusi massa = 12 × 1 = 12 satuan massa atom.
- Atom Oksigen (O): Terdapat 6 atom. Total kontribusi massa = 6 × 16 = 96 satuan massa atom.
Dari data tersebut, kita dapat menghitung persentase massa unsur karbon dalam glukosa. Rumusnya adalah (jumlah atom C × Ar C / Mr glukosa) × 100%.
Persentase C = (72 / 180) × 100% = 40%. Jadi, hampir setengah dari massa glukosa berasal dari unsur karbon.
Studi Kasus Perhitungan Massa Spesifik
Teori menjadi lebih bermakna ketika diaplikasikan dalam perhitungan nyata. Studi kasus membantu kita melihat bagaimana hubungan antara mol, Mr, dan massa digunakan untuk memecahkan masalah kimia sehari-hari, mulai dari menimbang bahan hingga membandingkan jumlah zat yang berbeda.
Perhitungan Massa dari Jumlah Mol
Menghitung massa jika jumlah mol diketahui adalah penerapan langsung rumus m = n × Mr. Sebagai ilustrasi, kita hitung massa 2 mol gas metana.
Diketahui: n CH₄ = 2 mol, Mr CH₄ = 16 g/mol.Massa CH₄ = n × Mr = 2 mol × 16 g/mol = 32 gram.Jadi, 2 mol gas metana memiliki massa 32 gram.
Membandingkan Massa Zat yang Berbeda
Untuk membandingkan mana yang lebih besar antara 5 gram natrium dan 0.1 mol nitrogen, kita perlu menyatukan satuan keduanya, baik dalam gram maupun mol. Cara termudah adalah mengubah semuanya ke satuan massa (gram).
- Massa natrium sudah diketahui: 5 gram.
- Massa 0.1 mol nitrogen: m N₂ = n × Mr = 0.1 mol × 28 g/mol = 2.8 gram.
Dari perhitungan, terlihat bahwa 5 gram natrium memiliki massa yang lebih besar daripada 0.1 mol nitrogen (yang setara dengan 2.8 gram).
Data Massa untuk Jumlah Mol Tertentu
Tabel berikut menyajikan data massa dari 0.5 mol masing-masing zat, memberikan gambaran praktis tentang perbandingan fisiknya.
| Nama Zat | Rumus | Mr (g/mol) | Massa untuk 0.5 mol (g) |
|---|---|---|---|
| Natrium | Na | 23 | 11.5 |
| Metana | CH₄ | 16 | 8 |
| Nitrogen | N₂ | 28 | 14 |
| Glukosa | C₆H₁₂O₆ | 180 | 90 |
| Sulfur Dioksida | SO₂ | 64 | 32 |
Menghitung Jumlah Molekul dari Massa
Pertanyaan tentang jumlah molekul yang terdapat dalam suatu massa tertentu melibatkan bilangan Avogadro (6.022 × 10²³ molekul/mol). Prosedurnya adalah: ubah massa menjadi mol terlebih dahulu, lalu kalikan dengan bilangan Avogadro. Untuk 32 gram sulfur dioksida (SO₂ dengan Mr=64):
- Hitung jumlah mol: n = m / Mr = 32 g / 64 g/mol = 0.5 mol.
- Hitung jumlah molekul: Jumlah molekul = n × bilangan Avogadro = 0.5 × (6.022 × 10²³) = 3.011 × 10²³ molekul.
Aplikasi dalam Berbagai Kondisi dan Wujud Zat
Perhitungan massa tidak berhenti pada zat murni dalam keadaan standar. Dalam praktiknya, kita harus mempertimbangkan wujud zat (padat, cair, gas) dan konteks penggunaannya, seperti saat zat tersebut dilarutkan atau ketika membutuhkan konversi satuan. Pendekatan ini menjadikan perhitungan kimia relevan dengan situasi riil di laboratorium dan industri.
Pengaruh Wujud Zat pada Pengukuran Massa
Source: co.id
Perhitungan massa zat seperti glukosa, natrium, atau metana mengandalkan rumus dan standar yang presisi. Prinsip keteraturan ini mengingatkan pada sebuah Sistem Ekonomi yang Ditentukan Pemerintah , di mana alokasi sumber daya diatur secara terpusat untuk mencapai target tertentu. Demikian pula dalam kimia, ketepatan perhitungan massa nitrogen atau sulfur dioksida menjadi fondasi bagi reaksi dan analisis yang akurat serta dapat diprediksi.
Wujud zat mempengaruhi cara kita mengukur massanya, meskipun konsep massa intrinsik zat itu sendiri tidak berubah. Untuk zat padat, massa diukur langsung dengan menimbang. Untuk zat cair, sering kali yang diukur adalah volumenya terlebih dahulu, kemudian massanya dihitung menggunakan massa jenis (ρ = m/V). Gas memiliki sifat yang paling khusus; massanya sangat bergantung pada tekanan dan suhu karena volumenya mudah berubah.
Perhitungan massa zat seperti glukosa, natrium, atau metana mengandalkan presisi rumus kimia dan bilangan Avogadro, serupa dengan ketepatan yang dibutuhkan dalam menentukan Panjang rantai mengelilingi dua roda gigi bersinggungan dalam sistem mekanis. Kedua konsep ini sama-sama memerlukan pemahaman mendalam tentang hubungan antar komponen untuk mencapai hasil yang akurat, baik dalam konteks stoikiometri maupun aplikasi teknik.
Dalam perhitungan stoikiometri gas, kondisi standar (STP) atau kondisi ruang (RTP) sering menjadi acuan.
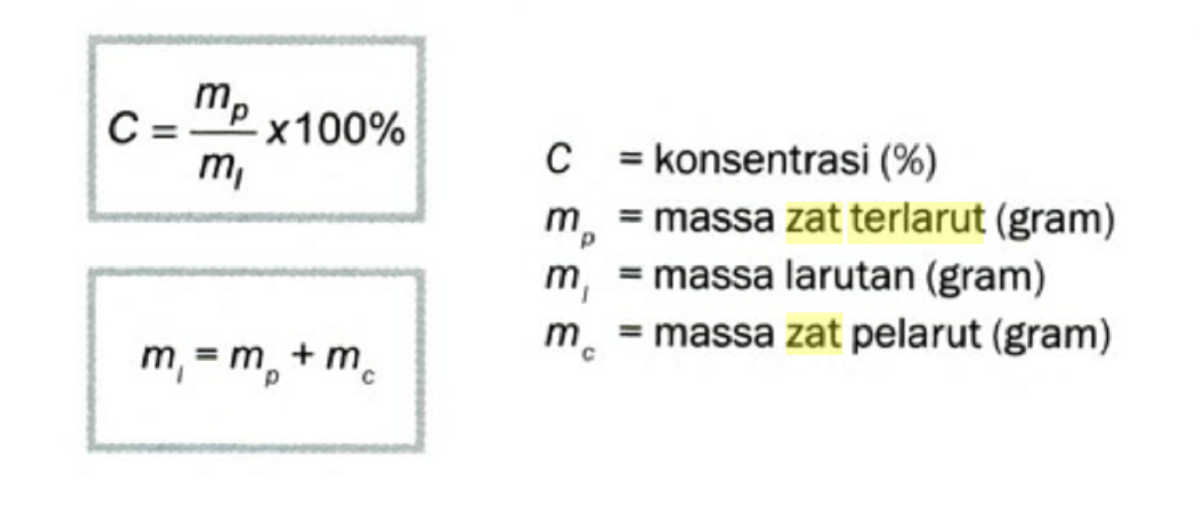
Perhitungan Massa Senyawa dalam Larutan
Saat bekerja dengan larutan, konsentrasi (biasanya molaritas, M dalam mol/L) menjadi variabel kunci. Untuk membuat larutan glukosa 0.1 M sebanyak 1 liter, kita perlu menghitung massa glukosa yang harus dilarutkan. Langkahnya adalah menentukan jumlah mol glukosa yang dibutuhkan terlebih dahulu.
n = M × V = 0.1 mol/L × 1 L = 0.1 mol.Massa glukosa = n × Mr = 0.1 mol × 180 g/mol = 18 gram.Jadi, 18 gram glukosa dilarutkan ke dalam air hingga volume larutan tepat 1 liter.
Konversi Satuan Massa dalam Percobaan Kimia
Ketepatan pengukuran massa sangat krusial. Alat timbang di laboratorium memiliki ketelitian berbeda, sehingga pemilihan satuan harus tepat. Konversi yang umum adalah: 1 gram (g) = 1000 miligram (mg) = 0.001 kilogram (kg). Saat menimbang natrium untuk reaksi yang sensitif, mungkin diperlukan satuan miligram. Sebagai contoh, 0.5 gram natrium setara dengan 500 miligram.
Ilustrasi Visual Massa Zat dalam Kondisi Ruang
Membayangkan massa yang setara dari zat yang berbeda wujud dapat meningkatkan pemahaman. Bayangkan 32 gram sulfur dioksida (kira-kira massa untuk 0.5 mol) sebagai sebuah bola pingpong kecil yang sangat padat jika dikondensikan menjadi cair. Sementara itu, 8 gram metana (0.5 mol) dalam wujud gas pada suhu kamar akan memenuhi balon kecil. Sedangkan 90 gram glukosa (0.5 mol) kira-kira setara dengan tiga sendok makan penuh gula pasir yang dipadatkan.
Perbandingan visual ini menunjukkan bahwa massa yang sama dapat menempati volume yang sangat berbeda tergantung pada massa jenis dan wujud zat.
Perbandingan Sifat dan Data Fisis Terkait Massa: Menghitung Massa Zat: Glukosa, Natrium, Metana, Nitrogen, Sulfur Dioksida
Massa molekul relatif (Mr) bukan sekadar angka untuk perhitungan, tetapi juga berkorelasi dengan berbagai sifat fisis zat. Membandingkan Mr dari kelima zat ini dapat memberikan wawasan awal tentang perilaku mereka, meskipun sifat fisis juga sangat dipengaruhi oleh jenis gaya antarmolekul dan struktur zat.
Urutan dan Perbandingan Massa Molekul Relatif
Berdasarkan perhitungan sebelumnya, urutan kelima zat dari yang paling ringan hingga paling berat Mr-nya adalah: Metana (CH₄, Mr=16) < Natrium (Na, Mr=23) < Nitrogen (N₂, Mr=28) < Sulfur Dioksida (SO₂, Mr=64) < Glukosa (C₆H₁₂O₆, Mr=180). Secara umum, dalam kelompok senyawa dengan jenis yang sama, Mr yang lebih besar cenderung berkaitan dengan titik didih yang lebih tinggi karena adanya peningkatan gaya dispersi London. Namun, perlu diingat bahwa hidrogen bonding pada glukosa dan sifat polar SO₂ membuat titik didih mereka lebih tinggi dari yang diperkirakan hanya berdasarkan Mr-nya jika dibandingkan dengan senyawa non-polar seperti metana dan nitrogen.
Tabel Data Fisis Kelima Zat
Tabel berikut merangkum Mr dan beberapa sifat fisis yang teramati pada kondisi suhu kamar (25°C).
| Nama Zat | Mr (g/mol) | Wujud pada Suhu Kamar | Massa Jenis (Pendekatan) |
|---|---|---|---|
| Metana | 16 | Gas | 0.000656 g/cm³ (gas) |
| Natrium | 23 | Padat | 0.97 g/cm³ |
| Nitrogen | 28 | Gas | 0.00125 g/cm³ (gas) |
| Sulfur Dioksida | 64 | Gas | 0.00263 g/cm³ (gas) |
| Glukosa | 180 | Padat | 1.54 g/cm³ |
Mengapa Ar Natrium Bulat Sementara Lainnya Desimal
Jika diperhatikan, Ar natrium sering ditulis sebagai 23, sebuah bilangan bulat. Sementara Ar karbon ditulis 12.01, oksigen 16.00, dan lain-lain yang memiliki angka desimal. Perbedaan ini berasal dari fakta bahwa sebagian besar unsur di alam terdiri dari campuran isotop, yaitu atom-atom dengan jumlah proton sama tetapi neutron berbeda. Ar adalah rata-rata tertimbang dari massa semua isotop alami suatu unsur berdasarkan kelimpahannya.
Natrium-23 adalah satu-satunya isotop alami yang stabil, sehingga Ar-nya tepat 23. Sebaliknya, karbon memiliki isotop C-12 (kelimpahan ~98.9%) dan C-13 (~1.1%), sehingga rata-ratanya menjadi 12.01. Angka desimal ini justru mencerminkan keakuratan pengukuran ilmiah terhadap komposisi alamiah unsur.
Kesimpulan
Dengan demikian, menjelajahi perhitungan massa dari glukosa hingga sulfur dioksida memberikan lebih dari sekadar jawaban numerik. Aktivitas ini melatih ketelitian, mengasah pemahaman tentang struktur materi, dan membuka jalan bagi berbagai eksplorasi ilmiah lanjutan. Penguasaan konsep ini merupakan bekal penting, baik untuk menjawab soal ujian, merancang eksperimen di laboratorium, maupun sekadar memuaskan rasa ingin tahu tentang komposisi segala sesuatu yang ada di alam semesta.
Pada akhirnya, setiap gram yang terhitung adalah sebuah langkah untuk memahami bahasa universal yang ditulis oleh atom-atom penyusun kehidupan.
Informasi Penting & FAQ
Apakah massa yang dihitung dengan rumus Mr sama dengan massa yang terukur di timbangan?
Ya, secara konseptual sama. Massa molekul relatif (Mr) dalam satuan atomik massa (u) setara dengan massa molar dalam gram per mol (g/mol). Jadi, massa 1 mol zat yang memiliki Mr tertentu, jika ditimbang, akan menghasilkan massa dalam gram yang nilainya sama dengan angka Mr-nya.
Mengapa kita perlu menghitung persentase massa unsur dalam suatu senyawa seperti pada glukosa?
Menghitung persentase massa berguna untuk berbagai analisis, seperti menentukan kemurnian suatu sampel, merancang formulasi dalam industri (misalnya pupuk atau obat), dan dalam analisis elemental untuk mengidentifikasi suatu senyawa yang tidak diketahui.
Bagaimana cara menghitung massa zat jika yang diketahui adalah volumenya (khusus untuk gas)?
Untuk gas pada kondisi tertentu (suhu dan tekanan), kita dapat menggunakan hukum gas ideal. Pertama, hitung jumlah mol (n) dari volume menggunakan rumus PV = nRT. Setelah jumlah mol didapat, massa dapat dihitung dengan mengalikannya dengan massa molar (Mr) zat tersebut.
Apakah perhitungan massa untuk natrium (unsur) berbeda dengan metana (senyawa)?
Prinsip dasarnya sama, yaitu menggunakan massa atom relatif (Ar). Untuk unsur seperti natrium, massa atom relatifnya (Ar Na) langsung digunakan sebagai massa molar. Untuk senyawa seperti metana, kita harus menjumlahkan total Ar dari semua atom penyusunnya untuk mendapatkan massa molekul relatif (Mr) terlebih dahulu.