Menghitung volume HCl 0,1 M untuk titik ekuivalen CaCO₃ 200 mL 250 mg itu seperti menyusun resep rahasia di balik sebuah eksperimen klasik. Bayangkan saja, kita punya sejumput batu kapur dan sebotol asam klorida, lalu tiba-tiba terjadilah sebuah tarian kimia di mana setiap partikel saling mencari pasangannya. Ini bukan cuma sekadar angka dan rumus, tapi cerita tentang bagaimana sesuatu yang padat dan keruh akhirnya menemui takdirnya dalam titik yang tepat, di mana semua sudah terbayar lunas.
Pada intinya, perhitungan ini adalah jantung dari analisis titrasi asam-basa yang banyak dipakai di laboratorium. Kita akan mengurai bagaimana sejumlah massa kalsium karbonat yang spesifik, yaitu 250 mg dalam 200 mL larutan, memerlukan volume tertentu dari asam klorida 0,1 M untuk mencapai kondisi netral sempurna. Proses ini melibatkan pemahaman mendalam tentang stoikiometri, di mana setiap molekul CaCO₃ bereaksi dengan dua ion H+ dari HCl, melepaskan gelembung karbon dioksida sebagai pertanda reaksi berlangsung.
Mengungkap Simfoni Reaksi antara Asam Kuat dan Garam Karbonat yang Terlarut
Di balik kesederhanaan meneteskan asam ke dalam labu berisi padatan putih, tersembunyi sebuah drama molekuler yang dinamis dan elegan. Reaksi antara asam klorida dan kalsium karbonat bukan sekadar pertukaran partikel; ia adalah sebuah simfoni koordinasi di tingkat mikroskopis, di mana molekul air menjadi panggung dan mediator utama. Memahami mekanisme ini membuka wawasan tentang bagaimana reaksi penetralan dan pelepasan gas berlangsung dalam medium cair.
Ketika kristal CaCO₃ yang keras memasuki air, ia tidak serta-merta larut sempurna. Ion kalsium (Ca²⁺) dan karbonat (CO₃²⁻) yang terikat kuat dalam kisi kristal mulai dikepung oleh molekul air yang bersifat polar. Molekul air berorientasi dengan ujung bermuatan negatif (oksigen) menghadap ion Ca²⁺, dan ujung bermuatan positif (hidrogen) menghadap ion CO₃²⁻, dalam proses yang disebut solvasi. Proses ini melemahkan gaya tarik antar ion dalam kristal, sehingga sejumlah ion terlepas ke dalam larutan membentuk suspensi.
Di sisi lain, HCl 0,1 M sudah berada dalam keadaan terionisasi sempurna menjadi ion H⁺ dan Cl⁻, dengan masing-masing ion juga tersolvasi oleh kumpulan molekul air.
Pertemuan antara ion H⁺ yang tersolvasi dengan ion CO₃²⁻ yang juga tersolvasi adalah inti dari reaksi ini. Ion H⁺ tidak langsung menyerang ion CO₃²⁻ secara utuh. Tahap pertama adalah transfer proton cepat dari ion H⁺ ke salah satu dari tiga atom oksigen dalam ion CO₃²⁻, membentuk ion bikarbonat (HCO₃⁻). Reaksi ini sangat cepat karena didorong oleh afinitas yang besar antara proton dan ion karbonat.
Ion HCO₃⁻ yang terbentuk masih memiliki kemampuan untuk menerima proton lagi. Dengan keberadaan ion H⁺ yang cukup dari titran, tahap kedua pun terjadi: protonasi kedua pada ion HCO₃⁻ membentuk asam karbonat (H₂CO₃). Asam karbonat adalah spesies yang sangat tidak stabil dalam air. Hampir seketika, ia terurai menjadi molekul karbon dioksida (CO₂) dan air (H₂O). Molekul CO₂ inilah yang awalnya terlarut dalam air, lalu ketika konsentrasinya meningkat, ia membentuk gelembung-gelembung gas yang kita lihat.
Dinamika tumbukan partikel yang menentukan kecepatan reaksi ini sangat dipengaruhi oleh konsentrasi, pengadukan, dan suhu, yang memastikan ion-ion pereaksi bertemu dengan frekuensi dan energi yang tepat.
Karakteristik Reaktan dalam Simfoni Kimia
Untuk memahami alur reaksi secara menyeluruh, penting untuk mengenal sifat-sifat utama dari kedua pemain utamanya. Tabel berikut membandingkan karakteristik HCl dan CaCO₃ dalam konteks titrasi ini.
| Karakteristik | HCl (Asam Klorida 0,1 M) | CaCO₃ (Kalsium Karbonat) |
|---|---|---|
| Sifat Fisik | Larutan bening, tidak berwarna, berbau tajam dan merangsang. | Padatan kristalin putih, tidak berbau, tidak larut dalam air secara signifikan. |
| Perilaku dalam Air | Terionisasi sempurna menjadi H⁺(aq) dan Cl⁻(aq). Termasuk elektrolit kuat. | Sukar larut, membentuk suspensi. Ion yang terlepas (Ca²⁺ dan CO₃²⁻) terhidrasi (tersolvasi) oleh air. |
| Peran dalam Stoikiometri Reaksi | Berperan sebagai sumber ion H⁺ (proton). Setiap molekul HCl menyumbang 1 ion H⁺ untuk bereaksi. | Berperan sebagai sumber ion CO₃²⁻. Setiap molekul CaCO₃ menyumbang 1 ion CO₃²⁻ yang dapat menetralkan 2 ion H⁺ (melalui dua tahap protonasi). |
| Fungsi dalam Percobaan | Berperan sebagai titran (larutan standar) yang ditempatkan di buret untuk ditambahkan secara terkontrol. | Berperan sebagai analit (zat yang dianalisis) yang ditempatkan di labu Erlenmeyer. |
Analogi Titik Ekuivalen dalam Kehidupan Sehari-hari
Konsep titik ekuivalen yang abstrak dalam kimia sebenarnya memiliki kemiripan dengan transaksi sederhana dalam hidup. Bayangkan kamu ingin menukar uang kertas Rp100.000 dengan uang logam Rp1.000. Tujuanmu adalah mendapatkan tepat 100 keping logam. Setiap kali kamu menyerahkan selembar uang kertas Rp10.000, kamu berhak mendapat 10 keping logam. Proses menukar uang kertas besar menjadi recehan ini analog dengan menambahkan titran.
Titik ekuivalen tercapai tepat ketika uang kertas Rp100.000 terakhir kamu serahkan dan kamu menerima keping logam ke-100. Penambahan satu keping logam ekstra pun tidak diperlukan lagi, karena transaksi sudah “stoikiometris” atau setara. Dalam titrasi, ion H⁺ dari HCl adalah “uang kertas” yang kita tukarkan (teteskan) untuk “membeli” atau menetralkan semua ion CO₃²⁻ yang ada, yang diibaratkan sebagai “hutang” recehan yang harus dilunasi.
Perubahan warna indikator adalah seperti petugas bank yang berkata, “Cukup, Pak, sudah tepat seratus keping,” menandai bahwa transaksi pertukaran telah mencapai kesetaraan yang sempurna.
Peta Jalan Stoikiometri dari Massa Padatan hingga Volume Titran
Perhitungan volume HCl yang dibutuhkan bukanlah angka ajaib, melainkan hasil akhir dari sebuah peta jalan logis yang dibangun di atas prinsip stoikiometri. Peta jalan ini memandu kita dari sesuatu yang dapat kita ukur secara fisik—massa serbuk CaCO₃—menuju sesuatu yang perlu kita ukur secara eksperimen—volume larutan HCl. Setiap langkah merupakan sebuah konversi satuan yang didasarkan pada hubungan proporsional tetap antar zat, yang dijembatani oleh konsep mol.
Langkah pertama adalah membangun jembatan antara dunia makroskopis (gram) dan dunia molekuler (jumlah partikel). Kita mulai dengan massa CaCO₃ murni, yaitu 250 mg atau 0,250 gram. Untuk mengubah massa ini menjadi jumlah entitas kimia (mol), kita membutuhkan “faktor konversi” yang disebut massa molar. Massa molar CaCO₃ dihitung dari jumlah atom penyusunnya: Kalsium (Ca, 40 g/mol), Karbon (C, 12 g/mol), dan Oksigen (O, 16 g/mol dikali 3).
Jadi, massa molar CaCO₃ adalah 40 + 12 + (16×3) = 100 g/mol. Angka 100 ini sangat praktis. Artinya, setiap 100 gram CaCO₃ mengandung 1 mol molekul CaCO₃. Dengan demikian, 0,250 gram setara dengan 0,0025 mol (didapat dari 0,250 g / 100 g/mol). Dari sini, kita masuk ke jantung stoikiometri: hubungan mol antarpereaksi.
Persamaan reaksi yang setara, CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O, memberitahu kita bahwa setiap 1 mol CaCO₃ membutuhkan 2 mol HCl untuk bereaksi sempurna. Oleh karena itu, mol HCl yang dibutuhkan adalah dua kali mol CaCO₃, yaitu 0,0050 mol.
Langkah terakhir adalah kembali ke dunia makroskopis, tetapi sekarang dalam satuan volume larutan. Kita tahu konsentrasi HCl adalah 0,1 M, yang berarti terdapat 0,1 mol HCl dalam setiap liter larutan. Hubungan ini, Molaritas (M) = mol / Volume (V), adalah alat kita. Untuk mencari volume (dalam liter) yang mengandung 0,0050 mol HCl, kita menyusun ulang rumus menjadi V = mol / M.
Dengan demikian, V = 0,0050 mol / 0,1 mol/L = 0,050 L, yang setara dengan 50 mL. Seluruh rangkaian logika ini adalah sebuah rantai proporsionalitas yang kuat, di mana keakuratan setiap mata rantai menentukan kebenaran hasil akhir.
Dua Metode Penyajian Perhitungan
Perhitungan yang sama dapat disajikan dalam bentuk yang berbeda untuk kejelasan yang beragam. Metode pertama adalah narasi prosedural yang telah dijelaskan. Metode kedua divisualisasikan dalam diagram alur berikut, yang menunjukkan konversi satuan secara bertahap.
Diagram Alur Konversi:
Massa CaCO₃ (250 mg = 0,250 g)
↓ (dibagi massa molar: 100 g/mol)
Mol CaCO₃ = 0,0025 mol
↓ (dikali rasio stoikiometri HCl:CaCO₃ = 2:1)
Mol HCl dibutuhkan = 0,0050 mol
↓ (dibagi konsentrasi HCl: 0,1 mol/L)
Volume HCl teoritis = 0,050 L = 50 mL
Sumber Potensial Ketidakpastian dalam Kalkulasi
Meskipun perhitungan teoritis tampak lurus, setiap tahapnya membawa sumber ketidakpastian yang dapat merambat ke hasil akhir volume. Pertama, pada tahap konversi massa, kemurnian CaCO₃ adalah faktor kritis. Jika sampel tidak 100% murni (mengandung lembab atau pengotor), massa 250 mg tidak sepenuhnya merepresentasikan massa CaCO₃ aktif, sehingga mol awal sudah bias rendah. Kedua, pada tahap stoikiometri, asumsi bahwa reaksi berjalan sempurna hingga tuntas sangat penting.
Jika ada kehilangan CO₂ yang tidak sempurna atau reaksi samping, rasio 2:1 mungkin tidak terpenuhi secara eksak dalam praktek, mempengaruhi perhitungan mol HCl. Ketiga, pada tahap konversi ke volume, konsentrasi larutan HCl 0,1 M dianggap absolut. Namun, larutan standar bisa mengalami pengenceran yang tidak akurat atau perubahan konsentrasi akibat penguapan atau kontaminasi, sehingga nilai molaritas yang digunakan dalam rumus tidak lagi tepat.
Ketidakpastian gabungan dari ketiga sumber ini dapat menyebabkan volume HCl yang dihitung secara teori (misalnya 50,0 mL) berbeda beberapa persen dari volume yang sebenarnya harus digunakan di laboratorium untuk mencapai titik ekuivalen.
Imajinasi Visual pada Titik Balik Kimiawi dalam Labu Erlenmeyer: Menghitung Volume HCl 0,1 M Untuk Titik Ekuivalen CaCO₃ 200 mL 250 mg
Titrasi asam-basa dengan indikator seringkali memberikan perubahan warna yang dramatis, tetapi titrasi CaCO₃ dengan HCl tanpa indikator warna khusus menawarkan pertunjukan visual yang berbeda, lebih halus namun tak kalah menarik. Pengamatan yang cermat terhadap labu Erlenmeyer dari awal hingga akhir titrasi mengungkapkan narasi fisik dari reaksi kimia yang sedang berlangsung, di mana setiap tahap memiliki ciri khasnya sendiri.
Awalnya, labu berisi 200 mL air dan 250 mg bubuk CaCO₃ putih membentuk suspensi keruh yang tidak homogen. Saat tetesan pertama HCl 0,1 M dari buret menyentuh larutan, gelembung-gelembung gas karbon dioksida yang sangat halus mulai muncul, terutama di sekitar lokasi tetesan jatuh. Semakin banyak HCl yang ditambahkan, suspensi secara perlahan mulai tampak lebih jernih karena padatan CaCO₃ terus-menerus larut dan bereaksi.
Nah, buat yang lagi ngitung volume HCl 0,1 M buat netralin CaCO₃ 200 mL 250 mg, prinsip stoikiometri dan titik ekuivalen ini kunci banget. Proses analisis kimia seperti ini punya logika yang seru, mirip kayak memahami pola-pola dalam ilmu lain, misalnya saat mempelajari Pengertian Deret Spektral untuk mengidentifikasi unsur. Kembali ke lab, setelah paham konsep dasarnya, perhitungan volume HCl yang dibutuhkan pun jadi lebih mudah dan akurat untuk menentukan konsentrasi sampel.
Gelembung CO₂ menjadi lebih banyak dan terlihat naik ke permukaan. Mendekati titik ekuivalen, laju pembentukan gelembung akan melambat karena jumlah ion CO₃²⁻ yang tersisa semakin sedikit. Tepat pada titik ekuivalen, semua CaCO₃ telah habis bereaksi. Jika kita menghentikan penambahan HCl tepat di saat ini dan membiarkan labu beberapa saat, larutan akan menjadi bening (kecuali jika ada pengotor yang tidak bereaksi), dan pembentukan gelembung akan berhenti karena tidak ada lagi sumber CO₃²⁻.
Setelah titik ekuivalen, kelebihan ion H⁺ akan terakumulasi dalam larutan, yang dapat dideteksi dengan indikator pH seperti metil jingga, yang akan berubah warna dari kuning ke merah muda.
Parameter yang Memodifikasi Pengamatan Visual
Beberapa faktor eksperimental dapat mengubah bagaimana kita melihat proses ini:
- Suhu: Suhu yang lebih tinggi umumnya meningkatkan kelarutan CO₂ dalam air, sehingga gelembung mungkin lebih sedikit terlihat. Sebaliknya, suhu yang lebih rendah dapat membuat gelembung lebih jelas tetapi juga memperlambat kinetika reaksi.
- Kecepatan Pengadukan: Pengadukan yang kuat dan konstan membantu mencampurkan titran dengan cepat, membuat reaksi lebih homogen dan gelembung terbentuk merata di seluruh larutan, bukan hanya di area tetesan. Pengadukan yang lemah dapat menyebabkan reaksi lokal dan membuat titik akhir sulit ditentukan secara visual.
- Konsentrasi dan Jenis Indikator (jika digunakan): Penambahan indikator asam-basa seperti metil jingga akan mengubah warna larutan. Jumlah tetesan indikator yang terlalu banyak dapat mengaburkan pengamatan terhadap kekeruhan suspensi atau gelembung. Pilihan indikator dengan rentang pH transisi yang tepat sangat krusial.
- Ukuran Partikel CaCO₃: Bubuk yang sangat halus akan larut dan bereaksi lebih cepat, menghasilkan gelembung yang lebih seragam dan titik akhir yang lebih tajam dibandingkan dengan butiran kasar.
Perjalanan Satu Ion H+ Menuju Takdirnya
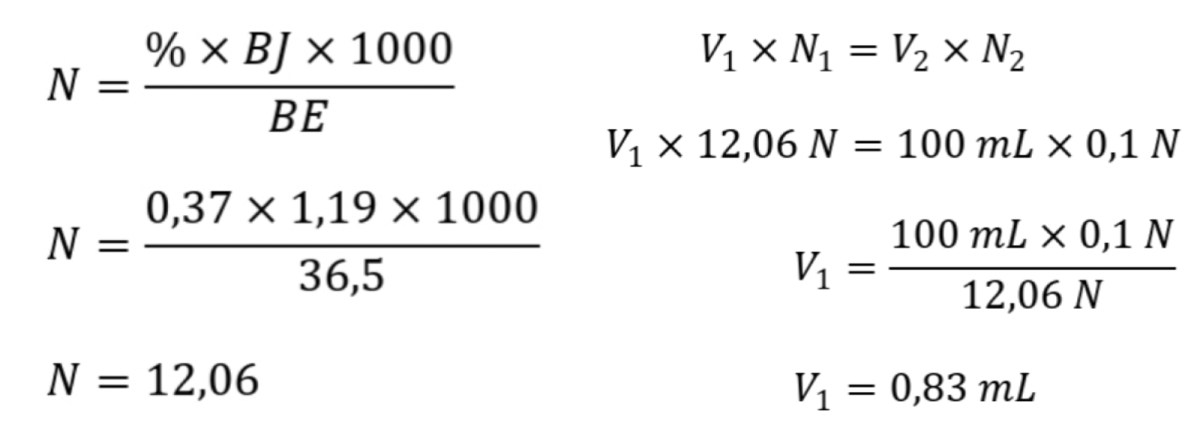
Source: googleusercontent.com
Mari kita ikuti perjalanan hipotetis satu ion H⁺ dari dalam buret. Ia terlarut dalam air, dikelilingi oleh beberapa molekul H₂O yang mengarahkan atom oksigennya ke arahnya (solvasi). Saat kran buret dibuka, ia tersapu arus larutan menuju ujung buret, lalu terjatuh sebagai bagian dari sebuah tetesan. Begitu mendaras di dalam suspensi CaCO₃ di labu, ia harus berenang melalui “lautan” molekul air dan ion-ion lain.
Rintangannya adalah kemungkinan bertabrakan dengan ion negatif lain seperti Cl⁻ (teman seperjalanannya) atau ion bikarbonat sementara (HCO₃⁻) dari reaksi tahap pertama. Namun, takdirnya adalah menemukan satu ion CO₃²⁻ yang tersisa. Dengan pengadukan yang baik, perjalanan ini dipercepat. Begitu berada dalam jarak yang sangat dekat, daya tarik elektrostatik yang kuat mengambil alih. Ion H⁺, yang pada dasarnya adalah sebuah proton, tertarik kuat ke salah satu atom oksigen bermuatan parsial negatif pada ion CO₃²⁻.
Dalam sekejap, terjadi transfer proton. Ion H⁺ itu sendiri, sebagai entitas individu, “lenyap” karena telah menyatu membentuk ikatan O-H baru, memulai rangkaian reaksi yang akhirnya membebaskan sebuah molekul CO₂. Perjalanan singkatnya telah mencapai akhir, dan kesetaraan stoikiometri dalam labu pun menjadi satu langkah lebih dekat.
Dialog antara Teori Ideal Larutan dan Realitas Praktek Laboratorium
Angka 50 mL yang kita peroleh dari perhitungan stoikiometri adalah volume teoritis yang ideal, hidup dalam dunia di mana semua reagen murni, alat ukur sempurna, dan reaksi berjalan instan dan tuntas. Dalam realitas laboratorium, angka ini adalah sebuah panduan, bukan sebuah takdir. Perbedaan antara volume teoritis dan volume yang benar-benar kita baca pada skala buret adalah ruang di mana faktor-faktor praktis berbicara, mengajarkan kita tentang batasan presisi, akurasi, dan seni dalam kerja eksperimental.
Pertama, konsep kemurnian reagen. Perhitungan kita mengasumsikan CaCO₃ yang kita timbang adalah 100% murni. Padahal, bahan kimia analitis sekalipun memiliki sertifikat kemurnian, misalnya 99,5%. Perbedaan 0,5% ini langsung mempengaruhi massa aktual CaCO₃ dalam sampel. Demikian pula, larutan HCl 0,1 M kita mungkin bukan tepat 0,1000 M, tetapi 0,0998 M atau 0,1005 M tergantung proses standardisasi.
Kedua, ketepatan alat ukur memainkan peran besar. Timbangan analitik memiliki ketidakpastian, misalnya ±0,0002 g. Untuk menimbang 0,250 g, ketidakpastian relatifnya sudah ada. Labu takar 200 mL dan buret 50 mL juga memiliki toleransi volume. Peniskalaan buret, cara membaca meniskus (dari atas atau bawah), dan bahkan sisa tetesan yang menempel di ujung buret dapat menambah atau mengurangi volume yang tercatat.
Ketiga, kepekaan dan pilihan indikator menentukan seberapa dekat kita dapat mendeteksi titik ekuivalen. Titik akhir titrasi (saat indikator berubah warna) hampir tidak pernah persis sama dengan titik ekuivalen teoritis (saat mol H⁺ = 2x mol CO₃²⁻). Perbedaan kecil ini disebut kesalahan indikator, yang bisa positif atau negatif. Semua faktor ini berinteraksi, membuat volume praktis yang kita dapatkan, misalnya 49,8 mL atau 50,4 mL, menjadi sebuah hasil yang lebih kaya makna daripada sekadar angka di kertas.
Spesifikasi Alat Gelas dan Dampak Toleransinya, Menghitung volume HCl 0,1 M untuk titik ekuivalen CaCO₃ 200 mL 250 mg
Setiap alat gelas memiliki spesifikasi teknis dan toleransi kalibrasi yang ditetapkan pabrikan. Toleransi ini adalah pengakuan bahwa pembuatan alat yang sempurna adalah mustahil, dan ia secara langsung mempengaruhi presisi pengukuran volume dalam titrasi.
| Alat Gelas | Kapasitas Umum | Kelas/Toleransi (Contoh) | Dampak pada Presisi Pengukuran |
|---|---|---|---|
| Labu Takar (Volumetric Flask) | 100 mL, 200 mL, 250 mL | Kelas A: ±0.08 mL (untuk 200 mL) | Ketidakpastian dalam membuat larutan sampel atau pengenceran larutan standar. Jika labu 200 mL kita sebenarnya 199.92 mL, konsentrasi yang dibuat sudah sedikit berbeda dari yang dituju. |
| Buret (Burette) | 25 mL, 50 mL | Kelas A: ±0.05 mL (untuk 50 mL) | Ketidakpastian pada setiap pembacaan volume. Perbedaan volume akhir dan awal (titik) melibatkan dua kali pembacaan, sehingga ketidakpastiannya mungkin berakumulasi. |
| Pipet Volumetrik (Volumetric Pipette) | 5 mL, 10 mL, 25 mL | Kelas A: ±0.03 mL (untuk 25 mL) | Ketidakpastian dalam memindahkan aliquot larutan, misalnya untuk standardisasi HCl atau preparasi sampel. |
| Gelas Ukur (Graduated Cylinder) | 100 mL, 250 mL | Ketelitian lebih rendah, misalnya ±0.5 mL (untuk 100 mL) | Biasanya tidak digunakan untuk pengukuran kritis dalam titrasi karena presisinya jauh lebih rendah dibanding alat volumetrik. |
Pentingnya Titrasi Blanko dan Pendahuluan
Untuk mendekatkan hasil praktek ke teori, dua teknik korektif sering dilakukan: titrasi blanko dan titrasi pendahuluan. Titrasi blanko adalah prosedur yang identik, tetapi tanpa kehadiran analit (CaCO₃). Ia mengukur volume titran yang diperlukan untuk menyebabkan perubahan warna indikator dalam pelarut saja atau untuk mencapai “titik akhir” sistem. Volume ini, meski kecil, sering muncul karena reaksi indikator dengan medium atau adanya pengotor reaktif dalam reagen.
Nilai titrasi blanko kemudian dikurangkan dari volume titran yang terpakai pada titrasi sampel. Koreksi ini membantu mengisolasi volume titran yang benar-benar bereaksi dengan analit, sehingga hasil perhitungan kadar menjadi lebih akurat.
Sementara itu, titrasi pendahuluan (atau titrasi kasar) dilakukan untuk memperkirakan secara cepat di mana kira-kira titik akhir akan terjadi. Hasilnya memberikan gambaran kasar, misalnya “sekitar 48-52 mL”. Dengan informasi ini, titrasi yang sebenarnya (titrasi halus) dapat dilakukan dengan penambahan titran yang sangat hati-hati (setetes demi setetes) ketika mendekati daerah tersebut. Ini mencegah penambahan titran berlebih yang signifikan, yang akan menyebabkan kesalahan besar, dan memungkinkan kita untuk menentukan titik akhir dengan presisi yang lebih tinggi.
Resonansi Aplikasi Penentuan Kadar Kalsium Karbonat di Berbagai Bidang
Prinsip dasar menghitung volume titran untuk menetralkan CaCO₃ bukan hanya sekadar latihan akademik di laboratorium sekolah. Ia beresonansi kuat dalam berbagai bidang analisis kimia terapan, di mana penentuan kadar kalsium karbonat atau kesadahan kalsium menjadi informasi kritis untuk pengambilan keputusan teknis, ekonomi, dan lingkungan.
Dalam pertanian, analisis kadar kapur (bahan pengkondisi tanah yang kaya CaCO₃) pada tanah sangat penting. Tanah yang terlalu asam (pH rendah) menghambat pertumbuhan banyak tanaman. Dengan menitrasi sampel tanah yang telah direaksikan dengan asam berlebih, kita dapat menentukan kapasitas penetralan tanah atau kebutuhan kapur (Lime Requirement). Di bidang pengelolaan air domestik, kesadahan air, yang terutama disebabkan oleh ion kalsium dan magnesium (sering dinyatakan setara CaCO₃), menjadi parameter kualitas.
Air sadah tinggi dapat menyebabkan kerak pada pipa dan pemanas, serta mengurangi efektivitas sabun. Titrasi kompleksometri dengan EDTA, yang prinsip stoikiometrinya mirip, adalah metode baku untuk menentukan kesadahan total. Dalam industri farmasi, kalsium karbonat digunakan sebagai eksipien (bahan tambahan) dalam tablet, misalnya sebagai pengisi atau zat antasid. Kontrol kualitas mensyaratkan analisis kemurnian bahan baku ini. Sampel CaCO₃ dari supplier dititrasi untuk memverifikasi bahwa kadar aktualnya sesuai dengan spesifikasi yang tertera pada sertifikat analisis, memastikan konsistensi dan keamanan produk obat yang dihasilkan.
Persamaan dan Perbedaan Preparasi Sampel
Sebelum analisis titrasi dilakukan, sampel dari ketiga bidang tersebut memerlukan preparasi yang berbeda-beda, meski tujuannya sama: mendapatkan ion Ca²⁺ atau CO₃²⁻ dalam bentuk yang dapat dititrasi.
- Tanah Pertanian: Sampel tanah dikeringkan, dihaluskan, dan ditimbang. Ia kemudian direaksikan dengan larutan asam (misalnya HCl) berlebih yang diketahui jumlah pastinya. Kelebihan asam ini kemudian dititrasi balik dengan basa standar. Perhitungannya tidak langsung, melibatkan selisih mol asam awal dan sisa.
- Air Domestik: Sampel air biasanya dapat dianalisis langsung atau dengan pengenceran minimal. Seringkali, buffer pH dan indikator khusus (seperti Eriochrome Black T) ditambahkan langsung ke dalam sampel air, lalu dititrasi dengan larutan EDTA standar. Preparasinya relatif sederhana karena matriksnya cair dan homogen.
- Bahan Baku Farmasi: Sampel padatan CaCO₃ ditimbang secara teliti dengan timbangan analitik, lalu dilarutkan dalam sejumlah kecil asam kuat (misalnya HCl) hingga larut sempurna. Larutan ini kemudian mungkin dinetralkan sebagian atau langsung dititrasi, tergantung metode yang dipilih. Fokusnya pada akurasi penimbangan dan kelarutan total sampel.
Implikasi Kesalahan Perhitungan yang Signifikan
Bayangkan jika dalam analisis kesadahan air untuk sebuah kompleks perumahan besar, terjadi kesalahan sistematis dalam perhitungan volume titran yang menyebabkan underestimasi kesadahan sebesar 20%. Implikasinya bisa bersifat teknis dan ekonomi. Secara teknis, air yang sebenarnya sangat sadah akan dianggap “lunak” atau “sedang”. Tanpa perlakuan pelunahan yang memadai, kerak kalsium karbonat akan dengan cepat menumpuk di dalam pipa distribusi, pemanas air, dan alat-alat rumah tangga seperti mesin cuci dan ketel.
Ini memperpendek umur pakai peralatan, meningkatkan biaya perawatan, dan menurunkan efisiensi energi akibat isolasi termal oleh kerak. Dalam jangka panjang, biaya penggantian infrastruktur pipa yang tersumbat parsial bisa sangat besar, jauh melampaui biaya untuk analisis yang akurat dan sistem pelunahan yang tepat ukuran. Kesalahan ini juga berdampak pada lingkungan secara tidak langsung, karena peralatan yang tidak efisien mengonsumsi lebih banyak energi dan sumber daya.
Penutupan
Jadi, begitulah kisah di balik perhitungan volume HCl untuk menaklukkan CaCO₃. Dari hitungan teoritis yang rapi di atas kertas hingga drama visual di dalam labu Erlenmeyer, setiap langkah mengajarkan ketelitian dan penghargaan terhadap detail. Perhitungan ini, meski terlihat seperti urusan laboratorium yang kaku, sebenarnya adalah sebuah alat yang powerful. Ia menjadi jembatan antara teori kimia yang elegan dengan realitas aplikatif, mulai dari memeriksa kesadahan air di rumah hingga memastikan kualitas bahan baku industri.
Pada akhirnya, menemukan titik ekuivalen itu bukan sekadar berhenti saat larutan berubah warna, tetapi tentang memahami momen keseimbangan yang sempurna di mana segala usaha pengukuran dan perhitungan berbuah menjadi sebuah kepastian.
FAQ dan Solusi
Apakah jenis indikator yang biasa digunakan untuk titrasi ini dan mengapa?
Indikator yang umum digunakan adalah Metil Jingga (Methyl Orange) karena perubahan warnanya (dari kuning ke merah) terjadi pada rentang pH yang sesuai untuk titrasi asam kuat (HCl) dengan basa konjugat dari asam lemah (CO₃²⁻ menjadi H₂CO₃).
Bagaimana jika sampel CaCO₃ tidak murni 100%? Bagaimana pengaruhnya terhadap perhitungan?
Jika sampel tidak murni, massa 250 mg yang ditimbang mengandung pengotor. Massa CaCO₃ sebenarnya akan lebih kecil, sehingga mol CaCO₃ yang bereaksi berkurang. Hasilnya, volume HCl 0,1 M yang dibutuhkan untuk mencapai titik ekuivalen akan lebih sedikit dari perhitungan teoritis.
Bisakah metode perhitungan ini digunakan untuk senyawa karbonat lain, seperti Na₂CO₃?
Bisa, prinsip stoikiometrinya serupa. Namun, perlu penyesuaian karena massa molekul relatif (Mr) yang berbeda. Selain itu, perbandingan mol dengan HCl juga perlu diperhatikan (misalnya, Na₂CO₃ juga bereaksi dengan perbandingan 1:2 dengan HCl).
Apa yang terjadi jika titrasi dilanjutkan melewati titik ekuivalen?
Larutan akan menjadi bersifat asam karena kelebihan ion H⁺ dari HCl. Jika menggunakan indikator Metil Jingga, warna akan menjadi merah yang lebih tua. Volume HCl yang terpakai akan tercatat lebih besar dari yang seharusnya, menyebabkan hasil perhitungan menjadi overestimate.
Mengapa dalam Artikel disebutkan tentang “titrasi blanko”? Apa fungsinya?
Titrasi blanko dilakukan untuk menentukan volume titran (HCl) yang digunakan untuk mengubah warna indikator saja, tanpa adanya sampel CaCO₃. Volume blanko ini kemudian dikurangkan dari volume titrasi sampel untuk mendapatkan volume HCl yang benar-benar bereaksi dengan CaCO₃, meningkatkan akurasi.