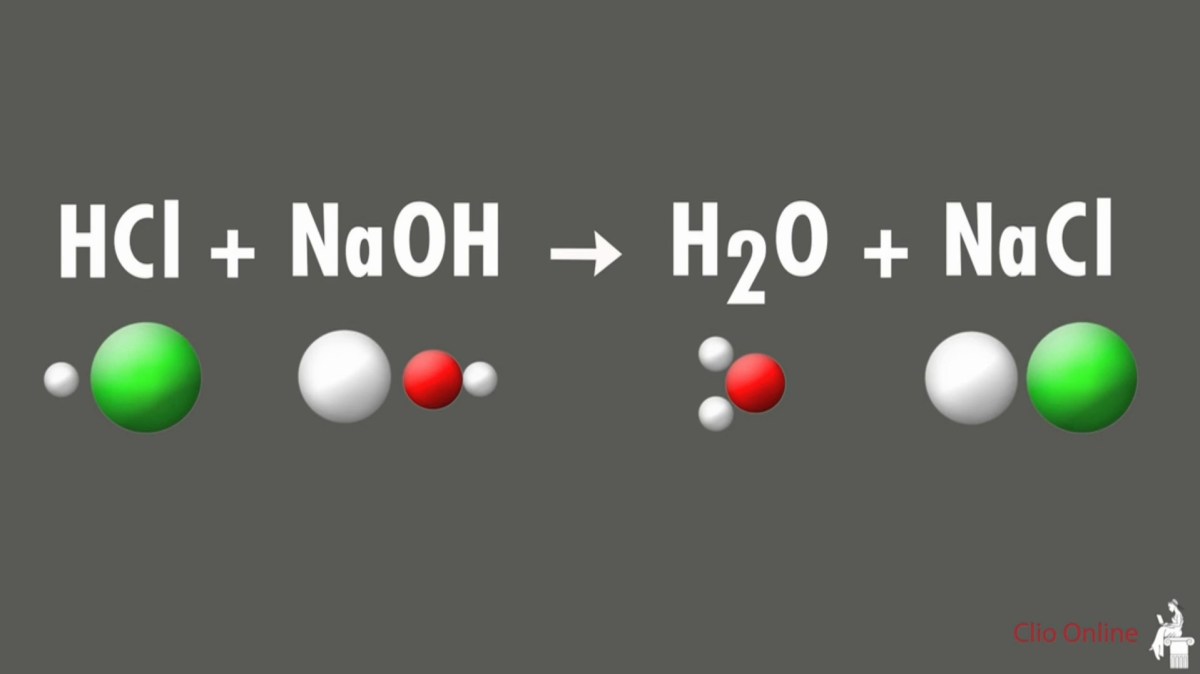
Reaksi Cl₂ dengan NaOH pekat panas: produk yang terbentuk menjadi sorotan utama karena menghasilkan senyawa penting seperti natrium hipoklorit dan natrium klorat yang banyak dipakai di industri. Pada suhu tinggi, klorin berubah menjadi ion‑ion oksidatif yang kemudian berinteraksi dengan basa kuat, menciptakan proses kimia yang kompleks namun sangat berguna.
Penggabungan gas klorin dengan larutan NaOH konsentrasi tinggi pada suhu di atas 70 °C memicu serangkaian reaksi yang menghasilkan NaClO dan NaClO₃ secara bersamaan. Kondisi eksperimental, rasio molar, serta kontrol temperatur menjadi faktor penentu kualitas dan kuantitas produk, sehingga pemahaman mendalam tentang mekanisme reaksi ini sangat penting bagi laboratorium riset maupun aplikasi industri.
Latar Belakang Reaksi Cl₂ dengan NaOH Pekat Panas
Reaksi antara klorin (Cl₂) dan natrium hidroksida (NaOH) pekat pada suhu tinggi menjadi inti dari proses produksi hipoklorit dan klorat. Kondisi eksperimental yang tepat diperlukan untuk memastikan rasio produk diinginkan serta keselamatan laboratorium.
Kondisi Eksperimental
Untuk menggabungkan Cl₂ dengan NaOH pekat pada suhu tinggi, laboratorium biasanya menyiapkan peralatan pendinginan, pengaduk magnetik, serta sistem ventilasi yang kuat. Suhu reaksi biasanya dijaga antara 70 °C hingga 110 °C, dengan konsentrasi NaOH 30‑50 % (w/w). Rasio molar Cl₂ : NaOH dapat diatur dari 1 : 1,5 hingga 1 : 2,5 tergantung pada target produk.
Reaksi Cl₂ dengan NaOH pekat panas menghasilkan hipoklorit dan klorida, serta air sebagai produk utama. Sementara itu, untuk meningkatkan pH larutan asam asetat 0,1 M hingga dua kali lipat, diperlukan penambahan molar CH3COONa yang tepat, lihat Mol CH3COONa untuk menggandakan pH larutan CH3COOH 0,1 M. Pengetahuan tentang stoikiometri ini membantu memahami keseimbangan kimia serupa, termasuk reaksi Cl₂ dengan NaOH pekat panas yang kembali menghasilkan produk yang sama.
| Suhu (°C) | Konsentrasi NaOH (%) | Rasio Molar Cl₂ : NaOH | Catatan |
|---|---|---|---|
| 70 | 30 | 1 : 1,5 | Pembentukan NaClO dominan |
| 90 | 40 | 1 : 2,0 | Kombinasi NaClO & NaClO₃ |
| 110 | 50 | 1 : 2,5 | NaClO₃ meningkat signifikan |
Persiapan Alat Laboratorium
Berikut langkah-langkah penting sebelum memulai reaksi:
- Siapkan bejana kaca berkapasitas 500 mL dengan penutup gas‑tight.
- Pasang termometer tahan korosi dan sambungkan ke kontrol suhu.
- Pasang pengaduk magnetik dan pastikan kecepatan 300 rpm.
- Hubungkan sistem ventilasi dengan filter aktif karbon.
- Kalibrasi pompa gas untuk aliran Cl₂ stabil (0,5 L/min).
Keselamatan utama: gunakan sarung tangan nitril, kacamata pelindung, dan pakaian laboratorium anti‑asam; pastikan area kerja memiliki aliran udara minimal 12 m³/menit.
Ilustrasi Visual Skema Reaksi
Skema reaksi dapat dibayangkan sebagai alur berikut: tabung reaksi berisi larutan NaOH pekat dipanaskan; gas Cl₂ masuk melalui selang ke dalam larutan, menghasilkan gelembung‑gelembung berwarna kuning-abu. Pada suhu tinggi, ion hipoklorit (OCl⁻) terbentuk di permukaan, sementara pada suhu lebih tinggi sebagian OCl⁻ teroksidasi menjadi ion klorat (ClO₃⁻). Seluruh proses berlangsung dalam satu fase cair dengan fase gas Cl₂ yang terlarut.
Persamaan Kimia Reaksi
Persamaan lengkap menggambarkan semua fase dan stoikiometri yang terlibat dalam reaksi antara klorin dan natrium hidroksida pekat panas.
Persamaan Reaksi Lengkap
2 Cl₂(g) + 2 NaOH(aq) → NaClO(aq) + NaCl(aq) + H₂O(l) (pada suhu ≤ 90 °C)
3 Cl₂(g) + 6 NaOH(aq) → 5 NaCl(aq) +O₃(aq) + 3 H₂O(l) (pada suhu > 90 °C)
| Koefisien | Zat | Fase | Catatan |
|---|---|---|---|
| 2 | Cl₂ | g | Gas klorin |
| 2 | NaOH | aq | Larutan pekat |
| 1 | NaClO | aq | Hipoklorit |
| 1 | NaCl | aq | Klorida natrium |
| 1 | H₂O | l | Air |
Peran Masing‑Masing Zat
- Cl₂ berfungsi sebagai agen pengoksidasi yang menyediakan atom klorin.
- NaOH berperan sebagai basa kuat yang menetralkan asam terbentuk dan menyediakan ion OH⁻ untuk pembentukan OCl⁻.
- NaClO adalah produk hipoklorit yang bersifat desinfektan.
- NaClO₃ terbentuk pada suhu tinggi melalui oksidasi lebih lanjut OCl⁻.
- H₂O merupakan produk sampingan yang membantu mengendalikan suhu reaksi.
Perubahan status oksidasi klorin: Cl₂ (0) → Cl⁻ (–1) pada NaCl, dan Cl⁺⁵ pada NaClO₃.
Diagram Molekuler Produk Utama
Ion hipoklorit (OCl⁻) dapat digambarkan sebagai atom klorin pusat yang terikat pada satu atom oksigen dengan muatan –1 pada keseluruhan ion. Struktur NaClO₃ menampilkan klorin pusat terikat pada tiga atom oksigen dalam konfigurasi trigonal, masing‑masing membawa muatan parsial negatif, menghasilkan ion klorat (ClO₃⁻) dengan muatan –1.
Mekanisme Reaksi: Reaksi Cl₂ Dengan NaOH Pekat Panas: Produk Yang Terbentuk
Mekanisme pada suhu tinggi melibatkan serangkaian langkah redoks dan deprotonasi yang mengarah pada pembentukan ion hipoklorit dan klorat.
Langkah‑Langkah Mekanistik
- Disosiasi Cl₂ menjadi Cl⁺ dan Cl⁻ di dalam medium basa.
- Cl⁻ bereaksi dengan OH⁻ membentuk ClOH⁻ (hipoklorit awal).
- ClOH⁻ terdeprotonasi menjadi OCl⁻ + H₂O.
- OCl⁻ pada suhu tinggi mengalami oksidasi lebih lanjut oleh Cl₂ menjadi ClO₃⁻.
| Langkah | Intermediat | Energi Aktivasi (kJ/mol) | Keterangan |
|---|---|---|---|
| 1 | Cl₂ → Cl⁺ + Cl⁻ | ≈ 150 | Inisiasi pada suhu ≥ 70 °C |
| 2 | Cl⁻ + OH⁻ → ClOH⁻ | ≈ 80 | Pembentukan hipoklorit awal |
| 3 | ClOH⁻ → OCl⁻ + H₂O | ≈ 65 | Deprotonasi cepat |
| 4 | OCl⁻ + Cl₂ → ClO₃⁻ + Cl⁻ | ≈ 120 | Oksidasi pada suhu tinggi |
Peran NaOH Sebagai Basa Kuat
- NaOH menyediakan ion OH⁻ yang menetralkan asam terbentuk selama disosiasi Cl₂.
- OH⁻ mempercepat deprotonasi ClOH⁻ menjadi OCl⁻.
- Konsentrasi tinggi NaOH menurunkan energi aktivasi pada langkah 2 dan 3.
- Pada suhu tinggi, kelebihan OH⁻ menstabilkan ion klorat yang terbentuk.
Nilai pKa penting: HClO (pKa ≈ 7,5) dan HClO₃ (pKa ≈ –1), menunjukkan hipoklorit lebih lemah sebagai asam dibandingkan klorat.
Transisi Struktural Ion
Selama reaksi, ion Cl⁻ beralih menjadi konfigurasi sp³d⁵ pada ClOH⁻, kemudian menyesuaikan menjadi sp² pada OCl⁻. Pada tahap oksidasi menjadi ClO₃⁻, klorin mengadopsi hibridisasi sp³ dengan tiga ikatan O–Cl yang terdistribusi secara trigonal, menandai perubahan geometri yang signifikan.
Produk Utama yang Terbentuk
Produk utama dari reaksi ini adalah natrium hipoklorit (NaClO) dan natrium klorat (NaClO₃). Kedua senyawa memiliki sifat kimia yang berbeda dan aplikasi industri yang luas.
Sifat Kimia Produk Utama
- NaClO: larutan berwarna kuning, bersifat oksidator lemah, pH sekitar 12‑13.
- NaClO₃: kristal putih, oksidator kuat, larutan pH > 13.
| Produk | Wujud | Titik Leleh (°C) | Titik Didih (°C) |
|---|---|---|---|
| NaClO | Larutan (aq) | ≈ -10 (larutan) | ≈ 150 (larutan) |
| NaClO₃ | Kristal | 84 | ≈ 300 (dekomposisi) |
Kegunaan Industri
Source: clio.me
- NaClO: desinfeksi air minum, pemutihan tekstil, pembersih rumah tangga.
- NaClO₃: bahan baku pembuatan klorin, agen pemutih industri kertas, pengolahan logam.
Stabilitas produk: NaClO stabil pada suhu < 25 °C dan pH > 11; NaClO₃ tetap stabil hingga 60 °C bila disimpan dalam wadah kedap udara.
Skema Pemisahan Produk
Pemisahan biasanya dilakukan dengan pendinginan bertahap. Larutan reaksi pertama-tama didinginkan hingga suhu 5 °C, sehingga NaClO tetap terlarut sementara NaClO₃ mengendap sebagai kristal. Endapan kemudian dipisahkan dengan filtrasi, dan larutan NaClO dipanen untuk aplikasi desinfeksi.
Produk Samping dan Sisi Reaksi
Selain NaClO dan NaClO₃, reaksi ini dapat menghasilkan beberapa produk samping yang perlu dikelola.
Produk Samping Umum
- ClO₂⁻ (ion klorito) terbentuk bila rasio NaOH terlalu tinggi pada suhu menengah.
- Cl⁻ berlebih muncul bila aliran Cl₂ tidak terkontrol.
| Produk Samping | Kondisi Terbentuk | Dampak Lingkungan | Catatan |
|---|---|---|---|
| ClO₂⁻ | NaOH > 55 % & suhu 80‑90 °C | Potensi toksik bila dilepas ke air | Harus dinetralkan |
| Cl⁻ (kelebihan) | Aliran Cl₂ rendah, suhu ≤ 70 °C | Rendah, namun meningkatkan salinitas limbah | Dapat didaur ulang |
Mitigasi Produk Samping
- Kontrol aliran gas Cl₂ dengan regulator tekanan.
- Gunakan penambahan NaOH bertahap, hindari kelebihan konsentrasi.
- Lakukan netralisasi ClO₂⁻ menggunakan asam fosfat ringan sebelum pembuangan.
Produk samping bersifat korosif, terutama ion klorito yang dapat mempercepat degradasi peralatan logam.
Diagram Alur Pengendalian Samping
Alur pengendalian dimulai dari pemantauan suhu dan aliran Cl₂ secara real‑time, diikuti oleh penyesuaian laju penambahan NaOH. Jika konsentrasi ClO₂⁻ terdeteksi (> 0,5 mM), aliran gas diturunkan dan larutan tambahan asam fosfat dimasukkan untuk mengubah ClO₂⁻ menjadi Cl⁻ yang lebih aman.
Pengaruh Temperatur Terhadap Hasil
Suhu berperan penting dalam menentukan rasio antara NaClO dan NaClO₃ yang terbentuk.
Variasi Suhu vs. Rasio Produk
| Suhu (°C) | NaClO (%) | NaClO₃ (%) | Keterangan |
|---|---|---|---|
| 70 | 85 | 15 | Hipoklorit dominan |
| 90 | 60 | 40 | Pergeseran ke klorat |
| 110 | 30 | 70 | Klorat utama |
Tren Rasio Produk
- Semakin tinggi suhu, energi aktivasi untuk oksidasi OCl⁻ menjadi ClO₃⁻ lebih mudah dicapai.
- Peningkatan suhu di atas 100 °C secara signifikan menurunkan yield NaClO.
- Pengaturan suhu 85‑95 °C memberikan kompromi optimal bagi produksi campuran NaClO/NaClO₃.
Suhu optimal untuk produksi NaClO murni berada pada kisaran 65‑80 °C dengan konsentrasi NaOH 30‑35 %.
Deskripsi Visual Grafik Suhu‑Produksi
Bayangkan grafik garis di mana sumbu X mewakili suhu (°C) dan sumbu Y persentase produk. Kurva NaClO menurun secara eksponensial, sementara kurva NaClO₃ meningkat secara logistik, keduanya berpotongan di sekitar 85 °C.
Aplikasi Praktis Produk
Produk NaClO dan NaClO₃ memiliki peran penting di berbagai sektor industri.
Aplikasi Utama
- NaClO: disinfeksi air bersih, pemutihan pakaian, pembersihan permukaan industri.
- NaClO₃: bahan baku pembuatan klorin, agen pemutih kertas, proses pengolahan logam non‑ferrous.
| Aplikasi | Konsentrasi (wt %) | Media | Catatan |
|---|---|---|---|
| Desinfeksi air minum | 0,1‑0,5 | Air | Waktu kontak 30 menit |
| Pemutihan tekstil | 2‑5 | Larutan soda | Suhu 60 °C |
| Pembuatan klorin industri | 10‑20 | Larutan NaClO₃ | Reaksi berkat elektrolisis |
| Pemutihan kertas | 5‑8 | Larutan NaClO₃ | Kontrol pH 12‑13 |
Keuntungan Penggunaan
- NaClO memberikan aksi antibakteri cepat tanpa meninggalkan residu berbahaya.
- NaClO₃ memiliki stabilitas tinggi pada suhu industri, cocok untuk proses berkelanjutan.
- Kedua produk mudah dihasilkan dari bahan baku sederhana (Cl₂, NaOH).
Regulasi: penggunaan NaClO dalam air minum dibatasi maksimum 5 mg/L menurut standar WHO; NaClO₃ harus disimpan dengan label bahaya oksidator kuat.
Ilustrasi Skenario Penggunaan, Reaksi Cl₂ dengan NaOH pekat panas: produk yang terbentuk
Bayangkan pabrik pengolahan air yang mengalirkan larutan NaClO 0,3 % melalui tangki kontak selama 30 menit. Setelah itu, air dialirkan ke filter karbon aktif untuk menghilangkan sisa klorin. Pada lini produksi kertas, NaClO₃ 7 % dicampur dengan pulp pada suhu 70 °C selama 20 menit, menghasilkan serat putih yang siap dikeringkan.
Reaksi Cl₂ dengan NaOH pekat panas menghasilkan natrium klorida, natrium hipoklorit, dan air sebagai produk utama. Menariknya, konsep perubahan energi pada 20 Benda di Sekitarmu: Fungsi dan Perubahan Energi membantu memahami bagaimana zat‑zat ini bertransformasi, sebagaimana dijelaskan dalam artikel 20 Benda di Sekitarmu: Fungsi dan Perubahan Energi. Pada akhirnya, hasil akhir reaksi tetap menghasilkan garam, pemutih, dan cairan yang penting dalam industri.
Metode Analisis Produk
Pengukuran kuantitatif NaClO dan NaClO₃ memerlukan prosedur analitis yang terstandarisasi.
Prosedur Analitis
- Titrasi iodometri untuk NaClO: larutan sampel ditambahkan KI, kemudian dikurangi dengan Na₂S₂O₃ hingga titik akhir biru muda.
- Spektrofotometri UV‑Vis untuk NaClO₃: mengukur absorbansi pada 260 nm setelah pengenceran dengan asam nitrat.
| Langkah | Reagen | Metode | Catatan |
|---|---|---|---|
| 1 | KI 0,1 M | Titrasi | Tambahkan hingga warna kuning stabil |
| 2 | Na₂S₂O₃ 0,02 M | Titrasi | End-point biru muda dengan starch |
| 3 | HNO₃ 0,5 M | Spektrofotometri | Pengenceran 1:10 sebelum pembacaan |
| 4 | Blank (air deionisasi) | Kalibrasi | Gunakan kurva standar NaClO₃ 0‑100 ppm |
Kriteria Validitas Data
- Reproduksibilitas harus < 2 % RSD pada tiga ulangan.
- Linearitas kurva standar minimal R² = 0,998.
- Laju titrasi konsisten ± 0,05 mL.
Kalibrasi alat (burette, spektrofotometer) harus dilakukan tiap hari kerja untuk menghindari drift hasil.
Visualisasi Hasil Analisis
Hasil titrasi biasanya disajikan dalam diagram batang yang menampilkan persentase NaClO per sampel, sedangkan data spektrofotometri divisualisasikan sebagai kurva absorbansi versus konsentrasi NaClO₃, memperlihatkan titik linear pada konsentrasi rendah.
Ulasan Penutup
Secara keseluruhan, reaksi antara Cl₂ dan NaOH pekat pada suhu tinggi tidak hanya menghasilkan produk utama yang berperan penting dalam desinfeksi dan pemutihan, namun juga menuntut perhatian khusus pada pengelolaan produk samping dan pengaturan suhu agar proses tetap aman dan efisien. Pengetahuan ini membuka peluang optimalisasi produksi NaClO dan NaClO₃ serta mitigasi dampak lingkungan.
Reaksi Cl₂ dengan NaOH pekat panas menghasilkan natrium hipoklorit (NaOCl) dan natrium klorida (NaCl) serta air. Bagi yang ingin mengasah logika matematika, contoh sederhana seperti Himpunan Penyelesaian x‑5 ≤ 3x‑1 membantu memahami batasan variabel sebelum kembali meninjau bagaimana produk tersebut berperan dalam disinfeksi industri kimia, menegaskan kembali pentingnya reaksi Cl₂ dengan NaOH pekat panas.
Pertanyaan yang Kerap Ditanyakan
Apa perbedaan utama antara NaClO dan NaClO₃ yang dihasilkan?
NaClO (hipoklorit) lebih stabil pada suhu rendah dan umum dipakai sebagai desinfektan, sedangkan NaClO₃ (klorat) terbentuk pada suhu tinggi dan memiliki potensi oksidasi yang lebih kuat, sering dipakai dalam proses pemutihan industri.
Bagaimana cara mengendalikan pembentukan produk samping seperti ClO₂⁻?
Dengan mengatur rasio molar Cl₂/NaOH, menjaga suhu dalam rentang optimal (70‑90 °C), dan menambahkan agen penyangga yang dapat menetralkan ion‑ion intermediat berbahaya.
Apakah reaksi ini dapat dilakukan tanpa risiko korosif?
Risiko korosif tetap ada karena klorin dan basa kuat; penggunaan peralatan tahan karat, ventilasi yang baik, serta perlindungan pribadi (sarung tangan, goggles) sangat diperlukan.
Metode analisis apa yang paling akurat untuk kuantifikasi NaClO?
Titrasi iodometri dengan standar natrium thiosulfat memberikan hasil yang akurat, sedangkan spektrofotometri dapat digunakan untuk pengukuran cepat pada konsentrasi rendah.