Tentukan rumus molekul hidrokarbon dari hasil pembakaran 20 cm³. Pada dasarnya, proses pembakaran hidrokarbon menghasilkan karbon dioksida (CO₂) dan air (H₂O) dalam proporsi yang tergantung pada struktur molekul bahan bakar. Dengan memahami prinsip stoikiometri serta hubungan volume‑mol pada kondisi standar, kita dapat mengubah data volume gas yang diukur menjadi informasi kimia yang berguna.
Langkah pertama adalah mengonversi volume gas hasil pembakaran dari cm³ ke liter, lalu menghitung jumlah mol menggunakan persamaan n = V/22,4 L. Setelah diperoleh total mol, rasio mol CO₂ terhadap H₂O dihitung untuk menebak jumlah atom C dan H dalam hidrokarbon asal. Tabel perbandingan, diagram alur, dan ilustrasi visual membantu memvisualisasikan proses ini secara sistematis, sehingga penentuan rumus molekul menjadi lebih mudah dan akurat.
Penjelasan Dasar Reaksi Pembakaran Hidrokarbon
Pembakaran hidrokarbon merupakan reaksi kimia antara senyawa organik yang hanya mengandung karbon (C) dan hidrogen (H) dengan oksigen (O₂) di udara. Pada kondisi standar, produk utama yang terbentuk adalah karbon dioksida (CO₂) dan air (H₂O). Memahami stoikiometri reaksi ini penting untuk dapat menghubungkan volume gas yang terukur dengan jumlah mol bahan bakar yang terbakar.
Prinsip Stoikiometri dalam Pembakaran Hidrokarbon
Setiap hidrokarbon dengan rumus umum C nH m bereaksi dengan oksigen menurut persamaan:
CnH m + (n + m/4) O₂ → n CO₂ + (m/2) H₂O
Pembacaan persamaan di atas menunjukkan bahwa satu mol hidrokarbon menghasilkan n mol CO₂ dan m/2 mol H₂O. Karena semua zat berada dalam fase gas pada kondisi standar (0 °C, 1 atm), volume gas berbanding lurus dengan jumlah mol (Hukum Avogadro).
Hubungan Volume Gas dan Jumlah Mol pada STP
Pada suhu dan tekanan standar (STP), satu mol gas menempati 22,4 L atau 22 400 cm³. Jadi, volume (V) yang terukur dapat langsung dikonversi menjadi jumlah mol (n) dengan rumus:
n = V / 22,4 L (dengan V dalam liter)
Tentukan rumus molekul hidrokarbon dari hasil pembakaran 20 cm³. Saat menghitung, kadang kita juga menemukan data menarik lain, seperti Berat Rata‑Rata Anak Perempuan Berdasarkan Data Anak Laki‑Laki yang memberi insight tentang perbedaan biologis. Kembali ke kimia, analisis volume gas hasil bakar membantu mengidentifikasi jenis hidrokarbon secara akurat.
Konversi satuan sangat penting; misalnya 20 cm³ = 0,020 L.
Faktor‑Faktor yang Mempengaruhi Hasil Pembakaran
- Suhu: Peningkatan suhu mempercepat laju reaksi dan dapat meningkatkan konversi bahan bakar menjadi CO₂ dan H₂O.
- Tekanan: Pada tekanan lebih tinggi, volume gas berkurang, sehingga pengukuran volume harus dikoreksi ke kondisi standar.
- Komposisi Bahan Bakar: Campuran hidrokarbon (misalnya campuran metana‑etana) mengubah rasio n dan m, sehingga memengaruhi perbandingan volume CO₂ dan H₂O yang terbentuk.
Langkah Menghitung Jumlah Mol dari Volume 20 cm³ Gas Hasil Pembakaran
Setelah volume total gas hasil pembakaran diukur (20 cm³), langkah selanjutnya adalah mengubah nilai tersebut menjadi jumlah mol agar dapat dianalisis secara kuantitatif.
Konversi Volume dan Perhitungan Mol
- Ubah volume dari cm³ ke liter: 20 cm³ ÷ 1 000 = 0,020 L.
- Gunakan rumus n = V / 22,4 L untuk menghitung mol total.
- Hitung: n = 0,020 L / 22,4 L mol⁻¹ ≈ 8,93 × 10⁻⁴ mol.
Tabel Konversi Volume ke Mol
| Volume (cm³) | Mol |
|---|---|
| 20 | 8,93 × 10⁻⁴ |
Hasil Perhitungan dalam Bentuk Poin
- Volume terukur: 20 cm³ (0,020 L).
- Mol total gas: ≈ 8,93 × 10⁻⁴ mol.
- Nilai ini menjadi dasar untuk menghitung mol CO₂ dan H₂O secara terpisah pada langkah berikutnya.
Menentukan Rasio Mol CO₂ dan H₂O untuk Mengidentifikasi Jenis Hidrokarbon
Rasio antara mol CO₂ dan H₂O yang terbentuk memberi petunjuk tentang jumlah atom C dan H dalam molekul hidrokarbon asal. Dengan membandingkan rasio yang terukur dengan rasio teoritis untuk masing‑masing hidrokarbon, kita dapat memperkirakan rumus molekulnya.
Perhitungan Rasio Mol CO₂/H₂O, Tentukan rumus molekul hidrokarbon dari hasil pembakaran 20 cm³.
- Hitung mol masing‑masing produk menggunakan proporsi stoikiometri (n untuk CO₂, m/2 untuk H₂O).
- Rasio = (mol CO₂) / (mol H₂O).
- Bandingkan rasio terukur dengan nilai teoritis untuk metana (C₁H₄), etana (C₂H₆), propana (C₃H₈), dst.
Tabel Rasio Mol dan Identifikasi Hidrokarbon
| Jenis Hidrokarbon | Rumus Umum | Rasio CO₂/H₂O | Keterangan |
|---|---|---|---|
| Metana | C₁H₄ | 1 : 2 ≈ 0,50 | Rasio rendah, menunjukkan satu atom C. |
| Etana | C₂H₆ | 2 : 3 ≈ 0,67 | Rasio menengah, dua atom C. |
| Propana | C₃H₈ | 3 : 4 ≈ 0,75 | Rasio lebih tinggi, tiga atom C. |
| Butana | C₄H₁₀ | 4 : 5 ≈ 0,80 | Rasio mendekati 1, empat atom C. |
| Pentana | C₅H₁₂ | 5 : 6 ≈ 0,83 | Rasio mendekati nilai teoritis untuk lima atom C. |
Contoh Perhitungan Rasio
Metana (C₁H₄): CO₂ = 1 mol, H₂O = 2 mol → Rasio = 1/2 = 0,50 Etana (C₂H₆): CO₂ = 2 mol, H₂O = 3 mol → Rasio = 2/3 ≈ 0,67 Propana (C₃H₈): CO₂ = 3 mol, H₂O = 4 mol → Rasio = 3/4 = 0,75
Perbandingan Hasil Pembakaran Hidrokarbon Berbeda
Berikut ini contoh data hipotetik yang menunjukkan volume CO₂ dan H₂O yang dihasilkan ketika masing‑masing lima hidrokarbon menghasilkan total 20 cm³ gas pada kondisi standar.
Tabel Perbandingan Volume Produk
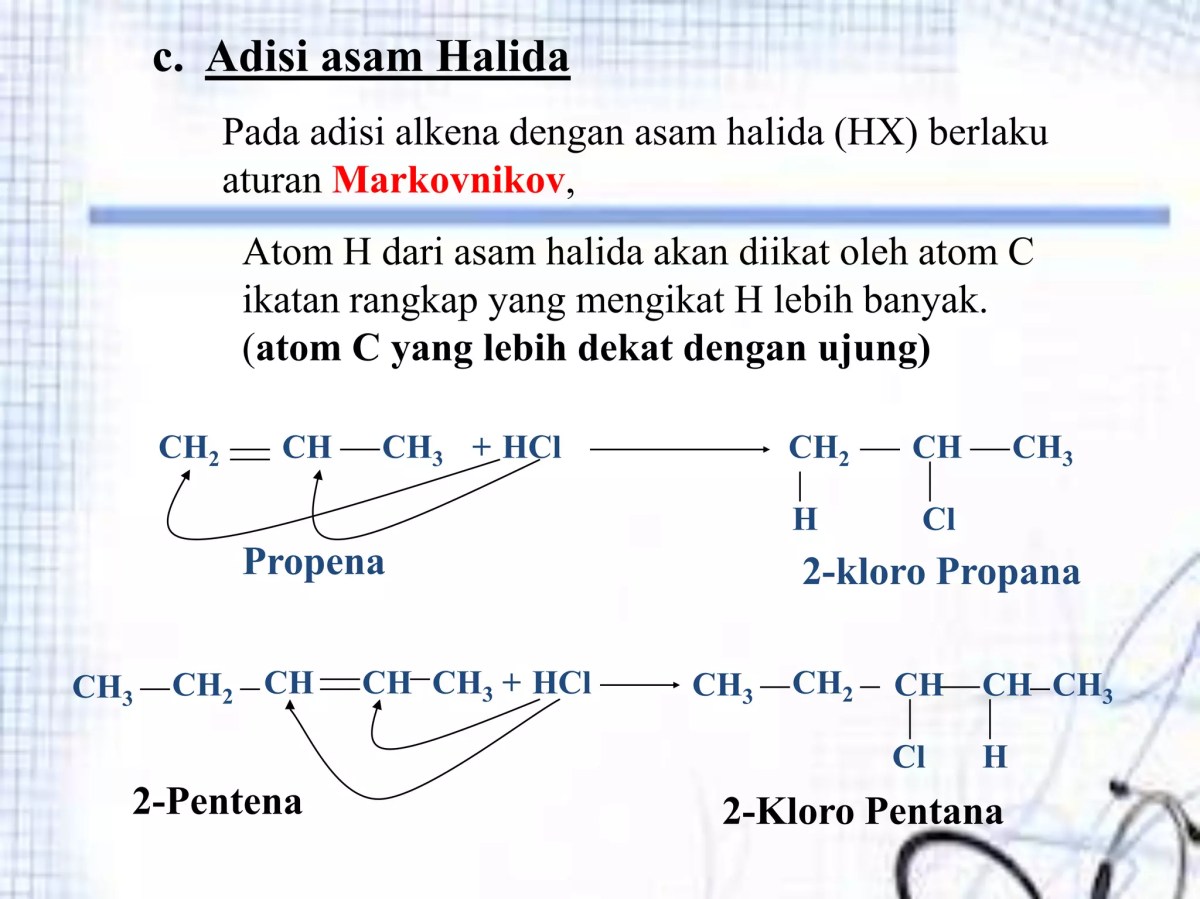
Source: slidesharecdn.com
| Hidrokarbon | Rumus Molekul | Volume CO₂ (cm³) | Volume H₂O (cm³) |
|---|---|---|---|
| Metana | C₁H₄ | 6,67 | 13,33 |
| Etana | C₂H₆ | 8,00 | 12,00 |
| Propana | C₃H₈ | 8,57 | 11,43 |
| Butana | C₄H₁₀ | 8,89 | 11,11 |
| Pentana | C₅H₁₂ | 9,09 | 10,91 |
Prosedur Pengisian Tabel
- Tentukan rasio mol CO₂/H₂O untuk tiap hidrokarbon (lihat tabel rasio).
- Hitung proporsi volume masing‑masing produk dengan mengalikan total volume (20 cm³) dengan fraksi mol produk.
- Bulatan hasil ke dua desimal untuk kepraktisan.
- Masukkan nilai ke dalam tabel sesuai kolom yang tersedia.
Pastikan semua volume dicatat dalam satuan cm³ agar perbandingan antar baris tetap konsisten.
Rancangan Diagram Alur Perhitungan Rumus Molekul dari Data Pembakaran: Tentukan Rumus Molekul Hidrokarbon Dari Hasil Pembakaran 20 cm³.
Diagram alur berikut menggambarkan langkah‑langkah logis mulai dari pengukuran volume hingga penentuan rumus molekul hidrokarbon.
[Mulai] | v [Konversi volume cm³ → L] | v [Hitung mol total gas (n = V/22,4)] | v [Tentukan proporsi mol CO₂ & H₂O (berdasarkan stoikiometri)] | v [Hitung rasio CO₂/H₂O] | v [Bandingkan dengan rasio teoritis] | v [Identifikasi nilai n dan m] | v [Tentukan rumus CₙHₘ] | v [Selesai]
- Setiap kotak [ ] mewakili proses perhitungan atau keputusan.
- Panah → menandakan alur logika dari satu langkah ke langkah berikutnya.
- Langkah “Bandingkan dengan rasio teoritis” melibatkan referensi tabel rasio yang telah disiapkan.
Ilustrasi Visual Proses Pembakaran Hidrokarbon
Gambaran visual yang dapat dibuat meliputi:
- Tabung reaksi berwarna transparan dengan skala volume yang jelas (0 cm³ – 30 cm³). Pada sisi tabung terdapat tanda “20 cm³” untuk menandai volume gas yang keluar.
- Nyala api berwarna oranye‑merah di bagian bawah tabung, menunjukkan proses pembakaran.
- Setelah api, dua aliran gas keluar dari ujung tabung: satu berwarna biru muda (menandakan uap air H₂O) dan satu berwarna merah terang (menandakan CO₂). Masing‑masing aliran dilengkapi label volume, misalnya “CO₂ = 8,57 cm³” dan “H₂O = 11,43 cm³”.
- Di latar belakang, diagram kecil menunjukkan persamaan stoikiometri yang digunakan.
Akurasi skala 20 cm³ sangat penting; setiap ketidaksesuaian mengubah perhitungan rasio dan, pada gilirannya, identifikasi rumus hidrokarbon.
Penutupan
Dengan mengikuti urutan konversi volume, perhitungan mol, dan analisis rasio CO₂/H₂O, kita dapat mengidentifikasi secara tepat jenis hidrokarbon yang terbakar. Pendekatan ini tidak hanya memperkuat pemahaman stoikiometri, tetapi juga memberikan alat praktis untuk aplikasi laboratorium maupun industri. Semoga panduan ini membantu mengubah data 20 cm³ gas menjadi wawasan kimia yang jelas.
FAQ Terperinci
Bagaimana cara memastikan kondisi standar saat mengukur volume gas?
Pastikan suhu 0 °C (273 K) dan tekanan 1 atm; gunakan tabung ukur yang terkalibrasi atau koreksi dengan persamaan keadaan ideal bila kondisi berbeda.
Apakah campuran hidrokarbon dapat dianalisis dengan metode ini?
Jika campuran menghasilkan satu set volume CO₂ dan H₂O total, rasio gabungan dapat memberikan perkiraan komposisi, tetapi akurasi menurun dibandingkan analisis hidrokarbon tunggal.
Mengapa volume H₂O diukur dalam satuan gas, padahal biasanya berupa uap?
Pada kondisi standar, uap air berperilaku seperti gas ideal, sehingga volume dapat dibandingkan langsung dengan CO₂ menggunakan hukum gas ideal.
Apa yang harus dilakukan jika volume total tidak tepat 20 cm³?
Gunakan faktor skala; hitung rasio mol berdasarkan volume yang terukur, lalu kalikan atau bagi dengan nilai referensi 20 cm³ untuk menyesuaikan perhitungan.
Bisakah hasil perhitungan digunakan untuk menentukan energi pembakaran?
Menentukan rumus molekul hidrokarbon dari hasil pembakaran 20 cm³ memerlukan analisis volume gas dan perbandingan stoikiometri. Sementara itu, untuk menambah perspektif matematika, Anda dapat melihat Nilai x yang Memenuhi Persamaan cos x = cos 110° dan mengaitkannya dengan perhitungan kimia. Dengan menggabungkan kedua pendekatan tersebut, kita dapat memperkirakan struktur hidrokarbon yang terbentuk dan memastikan hasil perhitungan konsisten dengan data eksperimental.
Secara tidak langsung, ya; mengetahui jumlah mol hidrokarbon memungkinkan perhitungan entalpi pembakaran bila nilai standar tersedia.


