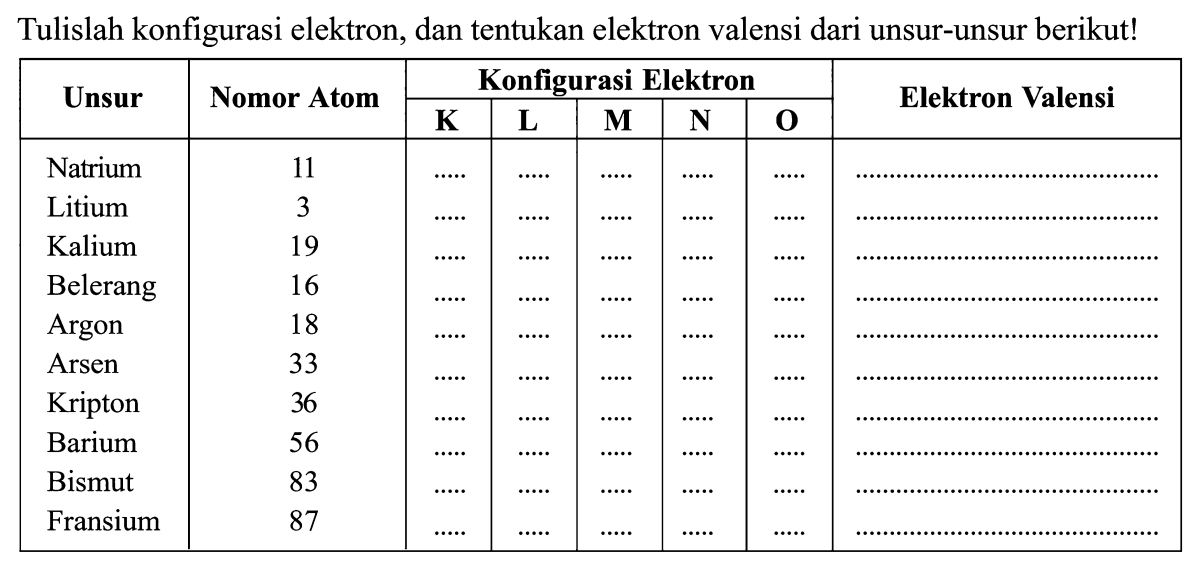
Tentukan Valensi Elektron untuk Unsur 61. Denger-denger sih, ngomongin elektron valensi itu kayak lagi ngulik karakter utama di film, yang kelakuannya bakal nentuin gimana ceritanya berantem atau berangkulan dengan unsur lain. Nah, unsur ke-61 ini, si Prometium, itu kayak karakter spesial yang jarang banget muncul di alam karena dia radioaktif, jadi nyari tahu valensinya tuh kayak misi rahasia.
Sebelum nyasar ke dia, kita inget-inget dulu konsep dasarnya. Valensi elektron tuh anak-anak nakal yang ada di kulit terluar atom, yang suka nongol kalo unsur lagi pengen ikatan kimia. Posisi unsur di tabel periodik, kayak di golongan dan periode apa, itu kunci utamanya. Tapi hati-hati, jangan sampe ketuker sama elektron di kulit dalam yang lebih kalem dan jarang ikut campur.
Contoh gampangnya, si Natrium yang cuma punya satu elektron valensi jadi suka ngasih, sementara si Klor yang butuh satu buat penuhin kulitnya jadi suka nerima.
Pengantar dan Definisi Dasar Valensi Elektron
Dalam mempelajari kimia suatu unsur, konsep valensi elektron merupakan kunci untuk memahami bagaimana dan mengapa unsur tersebut bereaksi. Valensi elektron adalah elektron yang berada pada kulit terluar (kulit valensi) dari suatu atom. Elektron-elektron inilah yang terlibat langsung dalam pembentukan ikatan kimia, baik itu ikatan ionik, kovalen, maupun logam. Jumlah dan susunan elektron valensi menentukan sifat kimia unsur, termasuk kereaktifan, jenis ikatan yang dibentuk, dan bilangan oksidasinya.
Posisi unsur dalam tabel periodik memberikan petunjuk langsung tentang elektron valensinya. Tabel periodik terbagi menjadi golongan (kolom vertikal) dan periode (baris horizontal). Golongan, khususnya untuk unsur golongan utama (blok-s dan blok-p), secara umum menunjukkan jumlah elektron valensi. Misalnya, semua unsur golongan 1 (alkali) memiliki 1 elektron valensi, sedangkan golongan 17 (halogen) memiliki 7 elektron valensi. Periode, di sisi lain, menunjukkan jumlah kulit elektron yang dimiliki atom.
Penting untuk membedakan elektron valensi dengan elektron pada kulit dalam. Elektron kulit dalam terletak lebih dekat ke inti atom dan terisi penuh, membuatnya sangat stabil dan tidak mudah terlibat dalam reaksi kimia. Mereka “melindungi” inti atom dan membentuk semacam lapisan inert. Sebaliknya, elektron valensi berada di posisi terluar, mengalami tarikan inti yang lebih lemah, dan dapat berinteraksi dengan elektron valensi dari atom lain.
Contoh Penentuan Valensi pada Unsur Golongan Utama, Tentukan Valensi Elektron untuk Unsur 61
Sebagai ilustrasi, mari kita lihat dua unsur yang sangat familiar: Natrium (Na, nomor atom 11) dan Klor (Cl, nomor atom 17). Konfigurasi elektron Natrium adalah 1s² 2s² 2p⁶ 3s¹. Kulit terluarnya adalah kulit ke-3 yang hanya berisi 1 elektron (3s¹). Jadi, Natrium memiliki 1 elektron valensi dan cenderung melepaskan elektron tersebut untuk mencapai kestabilan, membentuk ion Na⁺ dengan valensi +1.
Konfigurasi elektron Klor adalah 1s² 2s² 2p⁶ 3s² 3p⁵. Kulit terluarnya (kulit ke-3) memiliki 7 elektron (3s² 3p⁵). Klor memiliki 7 elektron valensi dan cenderung menarik 1 elektron untuk melengkapi kulit terluarnya menjadi 8 elektron, membentuk ion Cl⁻ dengan valensi -1. Kecenderungan ini menjelaskan mengapa Natrium dan Klor bereaksi hebat membentuk senyawa NaCl.
Identifikasi Unsur 61: Prometium
Unsur dengan nomor atom 61 adalah Prometium, dengan simbol kimia Pm. Unsur ini menempati posisi yang unik dan agak misterius dalam tabel periodik. Prometium adalah anggota deret Lantanida, yang merupakan bagian dari blok-f. Secara spesifik, ia terletak pada periode 6 dan, seperti semua lantanida, termasuk dalam golongan 3.
Sifat paling mencolok dari Prometium adalah statusnya sebagai satu-satunya lantanida yang bersifat radioaktif secara alami. Semua isotopnya tidak stabil. Isotop dengan waktu paruh terpanjang adalah Prometium-145, sekitar 17.7 tahun, dan Prometium-147, sekitar 2.62 tahun, yang biasa digunakan dalam aplikasi seperti baterai atomik. Karena sifat radioaktifnya yang relatif cepat ini, Prometium hampir tidak ditemukan dalam kerak bumi dalam jumlah yang signifikan; ia terbentuk secara alami dalam jumlah renik dari peluruhan uranium atau dihasilkan secara buatan dalam reaktor nuklir.
Konfigurasi Elektron dan Penentuan Valensi Prometium
Untuk menentukan valensi Prometium, kita harus menguraikan konfigurasi elektronnya. Sebagai unsur ke-61, elektron-elektronnya mengisi orbital sesuai aturan Aufbau. Konfigurasi elektron lengkap untuk Prometium (Pm) adalah: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s² 4f⁵.
Distribusi elektron per kulit (K, L, M, N, O, P) dan subkulit dapat dirinci sebagai berikut:
- Kulit K (n=1): 1s² (2 elektron)
- Kulit L (n=2): 2s² 2p⁶ (8 elektron)
- Kulit M (n=3): 3s² 3p⁶ 3d¹⁰ (18 elektron)
- Kulit N (n=4): 4s² 4p⁶ 4d¹⁰ 4f⁵ (25 elektron)
- Kulit O (n=5): 5s² 5p⁶ (8 elektron)
- Kulit P (n=6): 6s² (2 elektron)
Dari konfigurasi ini, kulit terluar adalah kulit ke-6 (kulit P) yang berisi 2 elektron pada subkulit 6s. Namun, dalam kimia unsur blok-f seperti lantanida, elektron pada subkulit 4f yang belum terisi penuh juga sangat penting dan sering berperan dalam menentukan sifat kimia dan valensi, meskipun secara teknis bukan bagian dari kulit terluar.
Langkah Sistematis Menentukan Valensi
Berikut adalah langkah-langkah yang dapat diikuti untuk menganalisis valensi berdasarkan konfigurasi elektron Prometium:
- Identifikasi Kulit Terluar: Tentukan kulit dengan bilangan kuantum utama (n) terbesar. Untuk Pm, ini adalah kulit n=6 (6s²).
- Identifikasi Subkulit yang Belum Penuh: Periksa subkulit selain kulit terluar yang belum terisi penuh atau setengah penuh. Pada Pm, subkulit 4f berisi 5 elektron (dari kapasitas maksimal 14).
- Analisis Kecenderungan Melepaskan Elektron: Unsur logam seperti lantanida cenderung melepaskan elektron untuk mencapai keadaan yang lebih stabil. Pm dapat melepaskan 2 elektron valensi dari kulit 6s, dan juga dapat melepaskan 1, 2, atau 3 elektron dari subkulit 4f yang tidak stabil.
- Pertimbangan Kestabilan Bilangan Oksidasi: Untuk lantanida, bilangan oksidasi +3 adalah yang paling stabil dan umum, karena menghasilkan konfigurasi yang relatif stabil (4fⁿ dengan n tertentu, atau kulit terluar yang kosong).
Analisis Berdasarkan Blok dan Golongan Lantanida
Prometium berada dalam blok-f, tepatnya di deret Lantanida. Unsur-unsur blok-f memiliki karakteristik khas dimana elektron terakhir masuk ke orbital f yang terletak lebih dalam, dilindungi oleh kulit 5s² dan 5p⁶. Hal ini menyebabkan jari-jari atom lantanida sangat mirip satu sama lain, menghasilkan sifat kimia yang sangat serupa. Pengaruh perlindungan ini juga berarti energi yang diperlukan untuk melepaskan elektron dari subkulit 4f tidak jauh berbeda dengan energi untuk melepaskan elektron valensi 6s dan 5d, sehingga memungkinkan munculnya lebih dari satu bilangan oksidasi.
Bilangan oksidasi +3 mendominasi di seluruh deret lantanida. Namun, beberapa unsur menunjukkan bilangan oksidasi +2 atau +4 berdasarkan kestabilan konfigurasi elektronik tertentu (misalnya, setengah penuh atau penuh). Neodymium (Nd, no. 60) di sebelah kiri Pm umumnya hanya menunjukkan +3. Samarium (Sm, no.
62) di sebelah kanan Pm dapat menunjukkan +2 dan +3, dimana Sm(II) relatif stabil karena konfigurasi 4f⁶.
Perbandingan dengan Unsur Lantanida Terdekat
| Unsur (Nomor Atom) | Konfigurasi Elektron Valensi | Valensi Umum | Keterangan |
|---|---|---|---|
| Neodymium (60) | 4f⁴ 6s² | +3 | Stabil pada +3. |
| Prometium (61) | 4f⁵ 6s² | +3 | Bilangan oksidasi paling stabil dan umum. |
| Samarium (62) | 4f⁶ 6s² | +2, +3 | Sm(II) cukup stabil karena konfigurasi 4f⁶ setengah penuh. |
Kemungkinan Bilangan Valensi dan Senyawa Contoh Prometium: Tentukan Valensi Elektron Untuk Unsur 61
Kemampuan Prometium untuk menunjukkan lebih dari satu bilangan valensi, meskipun terbatas, berasal dari energi ionisasi yang relatif berdekatan antara elektron 6s, 5d, dan 4f. Pelepasan dua elektron pertama (dari 6s) mudah terjadi. Pelepasan elektron ketiga (dari subkulit 4f) membutuhkan energi lebih besar, tetapi menghasilkan keadaan +3 yang sangat stabil untuk lantanida, di mana ion M³⁺ memiliki konfigurasi elektronik yang disukai.
Bilangan valensi yang paling umum dan stabil untuk Prometium adalah +3. Ini adalah keadaan oksidasi yang ditemukan di hampir semua senyawa Prometium yang diketahui. Senyawa dengan bilangan oksidasi +2 sangat jarang dan kurang stabil, karena konfigurasi 4f⁵ pada Pm(II) tidak memberikan stabilitas khusus seperti pada Samarium(II).
Contoh Senyawa Prometium
Source: amazonaws.com
Sebagai gambaran, berikut dua contoh senyawa yang mencerminkan valensi umum Prometium:
- Prometium(III) Klorida (PmCl₃): Senyawa garam ini menunjukkan valensi +3. Ia berbentuk padatan kristalin, larut dalam air, dan merupakan bahan awal sintesis untuk banyak senyawa Prometium lainnya. Ion Pm³⁺ dalam senyawa ini memiliki konfigurasi elektron [Xe] 4f⁴.
- Prometium(III) Oksida (Pm₂O₃): Oksida ini adalah bentuk oksida yang paling umum, lagi-lagi menegaskan dominasi bilangan oksidasi +3. Ia memiliki struktur kristal yang mirip dengan oksida lantanida trivalen lainnya.
Catatan penting dalam mempelajari kimia Prometium adalah sifat radioaktifnya yang kuat. Hal ini menimbulkan tantangan praktis yang signifikan: semua penelitian harus dilakukan dengan fasilitas dan protokol keselamatan radiasi yang ketat, jumlah sampel yang tersedia sangat terbatas, dan senyawa-senyawanya dapat mengalami radiolisis (penguraian oleh radiasi yang dipancarkannya sendiri) seiring waktu. Data eksperimen tentang senyawa Pm, terutama yang tidak umum seperti Pm(II), sangat langka akibat tantangan ini.
Visualisasi dan Representasi Struktur Prometium
Ilustrasi diagram kulit atom untuk Prometium akan menampilkan inti yang dikelilingi oleh enam konsentris kulit elektron. Kulit terdalam (K, L, M) terisi penuh dan padat. Kulit N (ke-4) dan O (ke-5) juga terisi penuh oleh subkulit s, p, dan d, dengan tambahan 5 elektron yang tersebar di orbital 4f pada kulit N. Di bagian paling luar, kulit P (ke-6) digambarkan dengan dua elektron yang relatif terpisah pada orbital 6s.
Dua elektron pada kulit terluar 6s inilah yang paling mudah hilang, dan bersama dengan satu elektron dari subkulit 4f, mereka membentuk dasar untuk keadaan oksidasi +3.
Representasi grafis sederhana untuk tren dalam deret Lantanida dapat dideskripsikan sebagai dua grafik yang sejajar. Grafik pertama menunjukkan jari-jari atom yang menurun secara halus dari Lantanum ke Lutesium, dikenal sebagai “kontraksi lantanida”. Grafik kedua menunjukkan kecenderungan valensi, dimana garis untuk bilangan oksidasi +3 tetap tinggi dan stabil sepanjang deret, sementara garis untuk +2 dan +4 hanya muncul pada puncak-puncak tertentu di unsur-unsur dengan konfigurasi f yang mendekati setengah penuh atau penuh (seperti Eu, Yb, Ce, Tb).
Prometium, dengan konfigurasi 4f⁵, berada tepat sebelum titik setengah penuh (4f⁷) dan hanya menunjukkan garis valensi +3 yang dominan.
Struktur Lewis untuk Senyawa Hipotetis
Menggambarkan struktur Lewis untuk senyawa ionik Prometium relatif sederhana. Mari ambil contoh hipotetis Prometium(III) Fluorida, PmF₃. Karena perbedaan keelektronegatifan yang besar, ikatannya bersifat ionik. Struktur Lewisnya akan fokus pada ion-ion yang terbentuk.
- Atom Prometium (Pm) melepaskan 3 elektron valensinya (2 dari 6s² dan 1 dari 4f⁵), membentuk ion Pm³⁺. Dalam struktur Lewis, ini sering ditunjukkan hanya sebagai “Pm³⁺”.
- Tiga atom Fluor (F, konfigurasi valensi 2s²2p⁵) masing-masing menerima satu elektron dari Pm, mencapai konfigurasi oktet gas mulia (Ne) dan berubah menjadi ion F⁻.
- Representasi akhirnya adalah [Pm]³⁺ dikelilingi oleh tiga ion fluorida, [F⁻]. Ikatan diwakili oleh gaya elektrostatik, bukan garis kovalen. Senyawa ini mengikuti “kaidah oktet” untuk anion fluorida, sedikan kation logam lantanida seperti Pm³⁺ umumnya tidak memenuhi oktet karena telah kehilangan semua elektron valensinya.
Simpulan Akhir
Jadi gitu ceritanya, setelah ngubek-ngubek konfigurasi elektron dan posisinya di blok-f, ketahuan deh rahasia si Prometium. Dia tuh punya potensi buat tampil dengan beberapa “kostum” bilangan valensi, tapi yang paling sering dipake dan stabil itu sih +3. Emang sih, ngulik dia penuh tantangan karena sifat radioaktifnya yang bikin penelitian nggak gampang. Tapi ya gitu, memahami karakter unik kayak gini justru bikin peta pengetahuan kimia kita makin rame dan berwarna.
Intinya, meski jarang ditemuin, perannya tetep penting buat ngelengkapin cerita besar di tabel periodik.
Daftar Pertanyaan Populer
Apakah valensi Prometium selalu +3?
Tidak selalu, meskipun +3 adalah yang paling stabil dan umum, Prometium juga dapat menunjukkan valensi +2 dalam beberapa senyawa tertentu, meskipun lebih jarang dan kurang stabil.
Mengapa sulit mempelajari senyawa Prometium di lab sekolah?
Karena Prometium adalah unsur radioaktif yang memancarkan radiasi, penanganannya memerlukan protokol keselamatan khusus dan fasilitas yang tidak tersedia di lab sekolah biasa.
Apakah elektron di subkulit 4f termasuk elektron valensi untuk Prometium?
Ya, untuk unsur lantanida seperti Prometium, elektron di subkulit 4f yang belum terisi penuh umumnya dianggap berkontribusi pada elektron valensi, berbeda dengan unsur golongan utama yang hanya melihat kulit terluar (n).
Bagaimana sifat radioaktif mempengaruhi penentuan valensinya secara eksperimen?
Sifat radioaktif menyebabkan sampel Prometium terus-menerus berubah (meluruh) menjadi unsur lain, sehingga pengukuran sifat kimia dan fisikanya menjadi kompleks dan membutuhkan teknik khusus serta pertimbangan waktu.

